题目内容
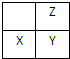 短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示.下列说法正确的是( )| A、若它们都为金属元素,则X的氧化物中只含离子键 |
| B、他们原子的最外层电子数的大小顺序一定是Z=Y>X |
| C、若它们存在X2-、Y-、Z-离子,则离子半径大小为Y->X2->Z- |
| D、Z元素的最高正化合价不一定大于X元素 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A.若都为金属元素,则X为Na、Y为Mg、Z为Be,X的氧化物有氧化钠、过氧化钠;
B.X可能为F、Y为Ne、Z为He;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.若Z为F元素,不存在正化合价.
B.X可能为F、Y为Ne、Z为He;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.若Z为F元素,不存在正化合价.
解答:
解:A.若都为金属元素,则X为Na、Y为Mg、Z为Be,X的氧化物有氧化钠、过氧化钠,过氧化钠中含有离子键、共价键,故A错误;
B.X可能为F、Y为Ne、Z为He,He与Ne的最外层电子数不相等,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径X2->Y->Z-,故C错误;
D.若Z为F元素,不存在正化合价,故D正确,
故选D.
B.X可能为F、Y为Ne、Z为He,He与Ne的最外层电子数不相等,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径X2->Y->Z-,故C错误;
D.若Z为F元素,不存在正化合价,故D正确,
故选D.
点评:本题考查结构性质位置关系应用,注意整体把握元素周期表的结构,B选项为易错点,学生容易忽略稀有气体,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于维生素的说法正确的是( )
| A、维生素都是极易溶于水 |
| B、服用维生素越多对人体越有好处 |
| C、维生素C怕高温,加热时间过长会破坏 |
| D、牙齿发黄,掉渣是因为缺少维生素 |
稀土有“工业维生素”的美称.近期地质学家在浙江西北部发现了巨型稀土矿.其中 含有一种元素钪,钪呈银白色,质软,易溶于酸.一般在空气中迅速氧化而失去光泽.主要存在于极稀少的钪钇石中.可用于制特种玻璃及轻质耐高温合金等.以下关于钪的说法中错误的( )
| A、钪是一种金属元素,产量较少 |
| B、钪的化学性质不活泼 |
| C、银白色和质软是钪的物理性质 |
| D、稀土矿是一种混合物 |
对下列实验过程的评价,正确的是( )
| A、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| B、验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| C、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| D、某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
下列离子方程式书写正确的是( )
| A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ |
| C、将少量硝酸银溶液滴入氨水中:Ag++2NH3?H2O═[Ag(NH3)2]++2H2O |
| D、碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列关于铝的叙述中,不正确的是( )
| A、铝是地壳里含量最多的金属元素 |
| B、在常温下,铝不能与氧气反应 |
| C、铝是一种比较活泼的金属 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
下列有机化合物的系统命名中正确的是( )
| A、3-甲基-5-异丙基庚烷 |
| B、2-甲基-2-丁烯 |
| C、2-甲基-3-丁炔 |
| D、4-乙基-2-戊醇 |
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.