题目内容
现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出).
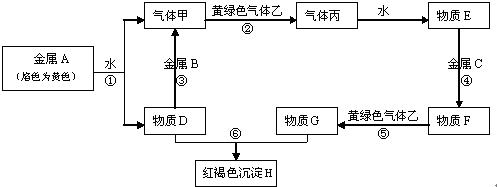
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A B F 丙 .
反应⑤ ;
反应⑥ .

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A
反应⑤
反应⑥
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl
物质F
物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题.
| 金属C |
| Cl2 |
解答:
解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl
物质F
物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)由以上分析可知,A为Na,B为Al,F为FeCl2,丙为HCl;
故答案为:Na,Al,FeCl2,HCl;
反应⑤氯化亚铁与氯气反应生成氯化铁,反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;
反应⑥是氯化铁与氢氧化钠反应生成氢氧化铁沉淀与氯化钠,反应离子方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;Fe3++3OH-═Fe(OH)3↓;
| 金属C |
| Cl2 |
(1)由以上分析可知,A为Na,B为Al,F为FeCl2,丙为HCl;
故答案为:Na,Al,FeCl2,HCl;
反应⑤氯化亚铁与氯气反应生成氯化铁,反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;
反应⑥是氯化铁与氢氧化钠反应生成氢氧化铁沉淀与氯化钠,反应离子方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;Fe3++3OH-═Fe(OH)3↓;
点评:本题是考查物质推断与性质、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.

练习册系列答案
相关题目
已知空气-锌电池的电极反应:锌片:Zn-2OH--2e-═ZnO+H2O,石墨:
O2+H2O+2e-═2OH-据次推断锌片是( )
| 1 |
| 2 |
| A、负极,被氧化 |
| B、负极,被还原 |
| C、正极,被氧化 |
| D、正极,被还原 |
-定条件下,2SO2(g)+O2(g)?2SO2(g)△H<0.下列有关叙述正确的是( )
| A、升髙温度,v正变大,v逆变小 |
| B、恒温恒容,充入O2,02的转化率升高 |
| C、恒温恒压,充人N2,平衡不移动 |
| D、恒温恒容,平衡前后混合气体的密度保持不变 |
对于相同体积的K2CO3溶液(浓度为c1)和(NH4)2CO3溶液(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系是( )
| A、c1=c2 |
| B、c1>c2 |
| C、c1≥c2 |
| D、c1<c2 |
 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A、曲线Ⅱ对应的条件改变是降低压强 |
| B、若曲线I对应的条件改变是升高温度,则该反应△H>0 |
| C、反应开始至a点时v(H2)=1mol?L-1?min-1 |
| D、其它条件不变,若降低该反应的温度,平衡常数值将减小 |
烧过菜的铁锅未及时洗涤,会出现红棕色锈斑.整个过程不可能发生的变化为( )
| A、2H2O+O2+4e-═4OH- |
| B、Fe-3e-═Fe3+ |
| C、Fe2++2OH-═Fe(OH)2 |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素的说法正确的是( )
| A、在自然界中既有化合态又有游离态 |
| B、单质常用作半导体材料 |
| C、气态氢化物很稳定 |
| D、最高价氧化物不与任何酸反应,可制光导纤维 |



