题目内容
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素的说法正确的是( )
| A、在自然界中既有化合态又有游离态 |
| B、单质常用作半导体材料 |
| C、气态氢化物很稳定 |
| D、最高价氧化物不与任何酸反应,可制光导纤维 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,则该非金属性元素为Si,结合Si元素单质化合物性质解答.
解答:
解:某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,则该非金属性元素为Si,
A.Si元素是亲氧元素,在自然界中以化合态形式存在,主要以二氧化硅、硅酸盐形式存在,故A错误;
B.Si单质是良好的半导体材料,故B正确;
C.Si的非金属性相对较弱,其氢化物不稳定,故C错误;
D.二氧化硅可以制备光导纤维,能与氢氟酸反应,故D错误,
故选B.
A.Si元素是亲氧元素,在自然界中以化合态形式存在,主要以二氧化硅、硅酸盐形式存在,故A错误;
B.Si单质是良好的半导体材料,故B正确;
C.Si的非金属性相对较弱,其氢化物不稳定,故C错误;
D.二氧化硅可以制备光导纤维,能与氢氟酸反应,故D错误,
故选B.
点评:本题考查原子结构与元素化合物性质,难度不大,注意掌握Si元素单质化合物性质的特殊性.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列实验与所得结论相符的是( )
| A、将碘水倒入分液漏斗,加适量乙醇,震荡后静置,能将碘萃取到乙醇中 |
| B、用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
| C、向某溶液中加入K3[Fe(CN)6]溶液,生成特征蓝色的沉淀,原溶液中含有Fe2+ |
| D、在含有FeCl2杂质的FeCl3溶液中通入足量的Cl2后,充分加热蒸干,可得到纯净的FeCl3 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2所含的氧原子数目为2NA |
关于反应2NaBr+Cl2═2NaCl+Br2,下列说法不正确的是( )
| A、Cl2是氧化剂,反应中Cl原子得到电子 |
| B、当1molCl2完全反应时,有2mol电子发生转移 |
| C、NaBr是还原剂,反应中溴离子得到电子 |
| D、当1molNaBr完全反应时,有1mol电子发生转移 |
升高温度,下列数据不一定增大的是( )
| A、化学反应速率v |
| B、水的离子积常数Kw |
| C、化学平衡常数K |
| D、弱酸的电离平衡常数Ki |
下列关于硫及其化合物的叙述,正确的是( )
| A、硫黄是一种易溶于水的黄色晶体 |
| B、SO2的水溶液显酸性 |
| C、SO2是黄色易溶于水的有毒气体 |
| D、SO2不稳定,极易转化为SO3 |
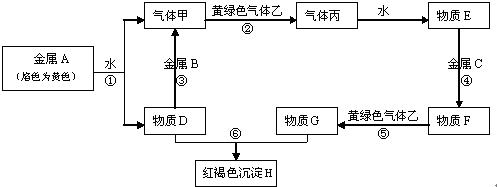
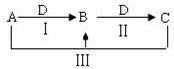 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).