题目内容
12. 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.(1)该实验应选用酚酞作指示剂,量取一定体积的白醋所用的仪器是酸式滴定管.
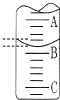
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+,H2O?OH+H+(用电离平衡方程式表示).
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈A(填序号).
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
分析 (1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;量取酸应该用酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度25,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(3)根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$,判断不当操作对V(标准)的影响;
(4)白醋溶液中存在的醋酸的电离平衡和水的电离平衡;
(5)根据溶液中的电荷守恒:c(CH3COOˉ)+c(OHˉ)=c(Na+)+c(H+)来解答;
(6)利用平均值计算醋酸溶液的体积,再根据酸度公式计算其物质的量浓度.
解答 解:(1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;白醋是酸,应该用酸式滴定管量取;
故答案为:酚酞;酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL;
故答案为:25.40;
(3)从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,测得的醋酸浓度偏大,
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积,导致V(标准)偏小,所以所测醋酸浓度偏小,故A错误;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡,导致V(标准)偏大,所以所测醋酸浓度偏大,故B正确;
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,导致氢氧化钠浓度偏小,所以V(标准)偏大,所测醋酸浓度偏大,故C正确;
D.加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,所以V(标准)偏小,所测醋酸浓度判断小,故D错误;
故答案为:BC;
(4)白醋溶液中存在电离平衡和水的电离平衡,电离方程式分别为:CH3COOH?CH3COO-+H+、H2O?OH+H+;
故答案为:CH3COOH?CH3COO-+H+;H2O?OH+H+;
(5)在滴定过程中,无论溶液中成分如何,都存在:c(CH3COOˉ)+c(OHˉ)=c(Na+)+c(H+),当c(CH3COOˉ)>c(Na+)时,c(OHˉ)<c(H+),混合溶液呈酸性;
故选:A;
(6)消耗NaOH溶液体积分别为:26.02mL,25.35mL,25.30mL,舍去第一组,NaOH溶液体积的平均值为$\frac{25.35mL+25.30mL}{2}$,
根据c(酸)=$\frac{c(碱)•V(碱)}{V(酸)}$,醋酸的物质的量浓度c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$;
故答案为:$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
点评 本题考查酸碱滴定实验,涉及电离平衡,盐类水解和化学计算,难度较大,会根据实际需要选取指示剂,注意滴定管上的刻度和量筒上刻度的区别,为易错点.

| A. | 滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变 | |
| B. | 滴定终点时混合溶液的pH=7 | |
| C. | 滴定终点时反应的热效应即为中和热 | |
| D. | 滴定终点时两者恰好完全反应 |
| A. | 1L 0.1mol•L-1氨水中有NA个NH4+ | |
| B. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| C. | 1L 0.1mol•L-1Na2SO3溶液中含有 0.1NA个SO32- | |
| D. | 1L 0.1mol•L-1AlCl3溶液中含有氯离子数为0.3NA |
| A. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 | |
| B. | 苯乙烯在一定条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴水反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |
| A. | 标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA | |
| C. | 标准状况下,22.4 L己烷中含共价键数目为19 NA | |
| D. | 18 g D2O和18 g H2O中含有的质子数均为10NA |
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | NH3易液化 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
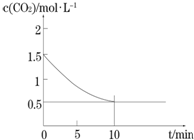 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.