题目内容
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1L 0.1mol•L-1氨水中有NA个NH4+ | |
| B. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| C. | 1L 0.1mol•L-1Na2SO3溶液中含有 0.1NA个SO32- | |
| D. | 1L 0.1mol•L-1AlCl3溶液中含有氯离子数为0.3NA |
分析 A.一水合氨为弱碱,部分电离;
B.常温下,Vm≠22.4L/mol;
C.亚硫酸根离子为弱酸根离子,水溶液中部分水解;
D.依据n=CV 计算氯化铝的物质的量,1个氯化铝中含有3个氯离子.
解答 解:A.1L 0.1mol•L-1氨水中,含有一水合氨物质的量为1mol,一水合氨为弱电解质,部分电离,所以电离产生NH4+小于NA个,故A错误;
B.常温下,Vm≠22.4L/mol,22.4 L CO2物质的量不是1mol,无法计算分子数目,故B错误;
C.1L 0.1mol•L-1Na2SO3溶液中含有0.1mol亚硫酸钠,亚硫酸根离子为弱酸根离子,水溶液中部分水解,所以含有 SO32-小于0.1NA个,故C错误;
D.1L 0.1mol•L-1AlCl3溶液中含有氯化铝物质的量为0.1mol/L×1L=0.1mol,氯化铝为强电解质,完全电离生成0.3mol氯离子,所以1L 0.1mol•L-1AlCl3溶液中含有氯离子数为0.3NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,侧重考查盐类水解、弱电解质电离,题目难度不大.

练习册系列答案
相关题目
18.下列有关电解质溶液的说法正确的是( )
| A. | 将FeCl2溶液在空气中加热蒸干并灼烧,最终得到黑色FeO固体 | |
| B. | 同浓度的氨水,NH4Cl、(NH4)2SO4溶液中水电离出氢离子浓度相同 | |
| C. | 一定浓度的氨水和盐酸混合存在关系:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 室温下,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则NaA溶液显酸性 |
12. 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
(1)该实验应选用酚酞作指示剂,量取一定体积的白醋所用的仪器是酸式滴定管.
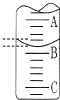
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BC
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+,H2O?OH+H+(用电离平衡方程式表示).
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈A(填序号).
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.(1)该实验应选用酚酞作指示剂,量取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+,H2O?OH+H+(用电离平衡方程式表示).
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈A(填序号).
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
16.有机物丁香油酚结构简式为: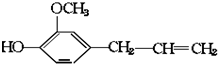 其可能具有的性质是( )
其可能具有的性质是( )
①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应.
 其可能具有的性质是( )
其可能具有的性质是( )①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应.
| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
17.下列关于SO2的叙述,正确的是( )
| A. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| B. | SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
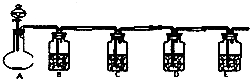 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示: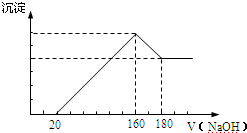
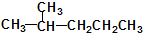 ②
②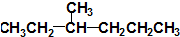 ③
③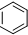
 ⑥
⑥