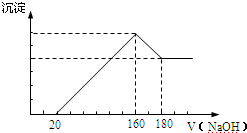
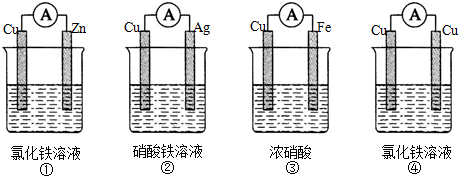
题目内容
20.回答下列问题:(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.
已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ/mol.
(2)已知:常温下0.1mol/L的某酸HA的pH=4,则该酸为弱酸(填“强”或“弱”),HA的电离方程式为HA?H++A-.
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a>b(填“>”、“<”或“=”,下同).
②将pH相同、体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a>b.
分析 (1)根据盖斯定律,由已知热化学反应方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写;
(2)部分电离的电解质是弱电解质,该溶液中氢离子浓度小于酸浓度,则HA是弱酸,部分电离;
(3)①盐酸是强酸、醋酸是弱酸,相同浓度的盐酸和醋酸,HCl电离程度大于醋酸,一元酸电离程度越大该酸溶液中氢离子浓度越大;
②pH相同的醋酸和盐酸,醋酸浓度大于盐酸,稀释过程中醋酸继续电离.
解答 解:(1)已知:①、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-l;
②、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-l;
由盖斯定律,②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),故该反应的△H=2×(-534kJ•mol-1)-67.7kJ•mol-1)=-1135.7 kJ•mol-1,
即2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1;
(2)酸中氢离子浓度小于HA,则HA部分电离,为弱电解质,是弱酸,其电离方程式为HA?H++A-,
故答案为:弱;HA?H++A-;
(3)①盐酸是强酸、醋酸是弱酸,相同浓度的盐酸和醋酸,HCl电离程度大于醋酸,一元酸电离程度越大该酸溶液中氢离子浓度越大,所以c(H+):a>b,故答案为:>;
②pH相同的醋酸和盐酸,醋酸浓度大于盐酸,稀释过程中醋酸继续电离,所以稀释相同的倍数时,醋酸中氢离子浓度大于盐酸,则pHa>b,故答案为:>.
点评 本题考查弱电解质的电离和盖斯定律,侧重考查学生分析计算能力,明确弱电解质电离特点是解本题关键,注意:电解质强弱与其电离程度有关,与电解质溶液导电性强弱无关,易错点是pH相同的不同一元酸浓度关系.

(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”,这种“金属”可能是含有硅碳的铁合金.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料.其中,生产普通玻璃的主要原料有纯碱、石英和石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
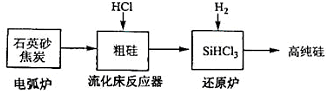
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
②在流化床反应的产物中,SiHCl3大约占 85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是H2、HCl.
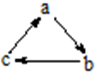 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HCl | H2CO3 | HClO |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=4 | B. | c(H+)=0.001 mol•L-1 | ||
| C. | c(OH- )=1×10-11 mol•L-1 | D. | c(H+):c(OH- )=1×104 |
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.(1)该实验应选用酚酞作指示剂,量取一定体积的白醋所用的仪器是酸式滴定管.
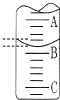
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+,H2O?OH+H+(用电离平衡方程式表示).
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈A(填序号).
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |