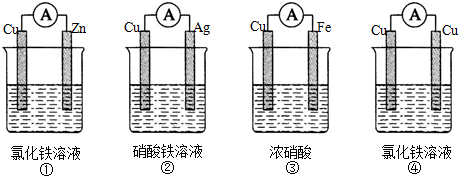
题目内容
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA | |
| C. | 标准状况下,22.4 L己烷中含共价键数目为19 NA | |
| D. | 18 g D2O和18 g H2O中含有的质子数均为10NA |
分析 A.标况下氢氟酸为液体;
B.1个乙烯分子含有4个C-H、1个C=C,共用电子对为6对,1个丙烯分子中含有6个C-H、1个C-C、1个C=C,共用电子对为:9对,乙烯和丙烯最简式都是CH2,相当于每个CH2共用3对电子;
C.标况下己烷为液体;
D.质量转化为物质的量,结合1个D2O和1个H2O中都含有10个质子;
解答 解:A.标况下,氢氟酸为液体不能使用气体摩尔体积,故A错误;
B.乙烯和丙烯最简式都是CH2,70g乙烯和丙烯混合物含有CH2单元0.5mol,含有共用电子对0.5mol×3=1.5mol,含有共用电子对的数目为1.5NA,故B正确;
C.标准状况下己烷为液体,不能使用气体摩尔体积,无法计算22.4 L己烷物质的量,故C错误;
D.18 g D2O物质的量为$\frac{18g}{20g/mol}$=0.9mol,含有9NA个质子,18 g H2O物质的量为$\frac{18g}{18g/mol}$=1mol,含有的质子数为10NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常的应用,主要考查气体摩尔体积的体积应用,质量换算物质的量计算微粒数,注意标况下HF和己烷为液体,题目难度不大.

练习册系列答案
相关题目
11.硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”,这种“金属”可能是含有硅碳的铁合金.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料.其中,生产普通玻璃的主要原料有纯碱、石英和石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
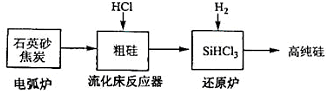
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;碳化硅又称金刚砂,其晶体结构与金刚石相似.
②在流化床反应的产物中,SiHCl3大约占 85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
③SiHCl3极易水解,其完全水解的产物为H4SiO4(或H2SiO3)、H2、HCl.
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是H2、HCl.
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”,这种“金属”可能是含有硅碳的铁合金.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料.其中,生产普通玻璃的主要原料有纯碱、石英和石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
②在流化床反应的产物中,SiHCl3大约占 85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是H2、HCl.
12. 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
(1)该实验应选用酚酞作指示剂,量取一定体积的白醋所用的仪器是酸式滴定管.
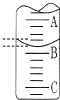
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BC
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+,H2O?OH+H+(用电离平衡方程式表示).
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈A(填序号).
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.(1)该实验应选用酚酞作指示剂,量取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.初读正确,实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗净,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)白醋溶液中存在的电离平衡为CH3COOH?CH3COO-+H+,H2O?OH+H+(用电离平衡方程式表示).
(5)在滴定过程中,当c(CH3COOˉ)>c(Na+)时,则混合溶液呈A(填序号).
A.酸性 B.碱性 C.中性 D.无法确定
(6)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c=$\frac{cmol•{L}^{-1}×\frac{25.35mL+25.30mL}{2}}{VmL}$.
9.除去下列有机物中的杂质,所选试剂正确的是(括号中的是杂质)( )
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |
16.有机物丁香油酚结构简式为: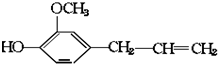 其可能具有的性质是( )
其可能具有的性质是( )
①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应.
 其可能具有的性质是( )
其可能具有的性质是( )①能发生加成反应,②能使酸性高锰酸钾溶液褪色,③能发生取代反应,④能与三氯化铁发生显色反应,⑤能发生中和反应,⑥能发生消去反应.
| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
6.金属锂是密度最小的金属,常用来制造高能量电池.已知锂的金属性介于钠和镁之间,则冶炼出金属锂的方法应该是( )
| A. | 电解法 | B. | 热还原法 | C. | 热分解法 | D. | 铝热法 |
13.下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |