题目内容
16.下列说法正确的是( )| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
分析 A.强酸能制取弱,比较酸性强弱,应在水溶液中进行;
B.二氧化硫与溴水发生氧化还原反应使溴水褪色;
C.制造光导纤维和玻璃都用到二氧化硅;
D.氮气不能引起温室效应.
解答 解:A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑是在高温下进行的反应,不能体现酸性的强弱,所以H2CO3酸性强于H2SiO3,不能用反应②进行解释,故A正确;
B.二氧化硫与溴水发生氧化还原反应使溴水褪色,体现二氧化硫的还原性,故B错误;
C.二氧化硅是生产光导纤维、玻璃的基本原料,故C正确;
D.CO2、CH4是温室气体,氮气不是,故D错误;
故选;C.
点评 本题考查了元素化合物知识,熟悉硅及其化合物性质是解题关键,注意二氧化硅与硅的用途区别,题目难度不大.

练习册系列答案
相关题目
6.在标准状况下,将CO2和CO的混合气体(标准状况下,该混合气体平均相对分子质量为32)充满一盛有足量Na2O2的容积为22.4L的密闭容器中,用间断的电火花引发至充分反应.反应完全后容器里的存在物叙述正确的是( )
| A. | 存在0.5 mol的CO | B. | 存在0.25 mol的Na2CO3 | ||
| C. | 存在0.125 mol的O2 | D. | 存在0.75 mol的Na2CO3 |
7.短周期元素W、X、Y和Z的原子序数依次增大.其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3.根据以上叙述,下列说法中正确的是( )
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
4.工业上常采用生物硝化法将NH4+转化NO3-的方法处理氨氮废水,工作流程如下,下列说法错误的是( )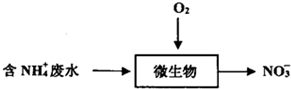

| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
11.根据元素周期律判断,下列关系正确的是( )
| A. | 离子半径:S2->Na+ | B. | 热稳定性:HCl>HF | ||
| C. | 酸性:H3BO3>H2CO3 | D. | 碱性:Al(OH)3>Ca(OH)2 |

 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应.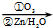 RCHO+R′CHO
RCHO+R′CHO .
. .
.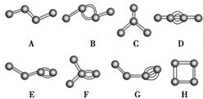 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.