题目内容
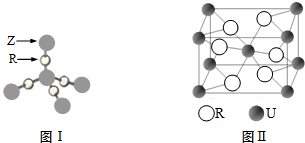
5. 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.a.图中属于甲烷同系物的是AC(填编号);
b.图中与B互为同分异构体的是EFH(填编号).
分析 a.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
b.分子式相同而结构不同的有机化合物互为同分异构体.
解答 解:a.只有A、C中碳原子和其他原子以共价单键结合,属于烷烃,属于甲烷同系物,
故答案为:A、C;
b.B为2-丁烯,分子式为C4H8,E、F、H的分子式都为C4H8,且它们的结构不同,所以B与E、F、H互为同分异构体,
故答案为:E、F、H.
点评 本题考查了球棍模型、有机化合物中碳的成键特征、同分异构体等知识,题目难度不大,注意掌握对信息的理解运用、读图方法,本题能够加深对同分异构体概念的理解,培养学生灵活应用所学知识的能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
16.下列说法正确的是( )
| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
13.已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)=2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
②N2(g)+3H2(g)=2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 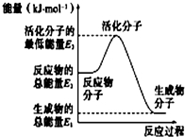 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
10.镁片和锌片用导线连接后插入稀硫酸中,锌片是( )
| A. | 比镁片活泼 | B. | 电子流出极 | C. | 正极 | D. | 负极 |
17. 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
(1)AF3分子中A的杂化类型为sp3,该分子的空间构型为三角锥形.
(2)基态C原子的电子排布式为1s22s22p63s2.第一电离能:A>B(填“>”或“<”“=”).
(3)A、B、D电负性由大到小的顺序为O>N>Si(用元素符号表示).
(4)D和A形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于原子晶体.
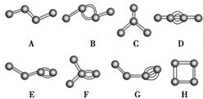
(5)E元素与A元素形成某种化合物的晶胞结构如图所示(黑球代表E原子),若该晶体的密度为ρg•cm-3,则该晶胞的体积是$\frac{206}{ρ{N}_{A}}$cm3.
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(2)基态C原子的电子排布式为1s22s22p63s2.第一电离能:A>B(填“>”或“<”“=”).
(3)A、B、D电负性由大到小的顺序为O>N>Si(用元素符号表示).
(4)D和A形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于原子晶体.
(5)E元素与A元素形成某种化合物的晶胞结构如图所示(黑球代表E原子),若该晶体的密度为ρg•cm-3,则该晶胞的体积是$\frac{206}{ρ{N}_{A}}$cm3.
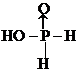 .H3PO2是一元(填“一”、“二”或“三”)酸.
.H3PO2是一元(填“一”、“二”或“三”)酸. .
.