题目内容
11.根据元素周期律判断,下列关系正确的是( )| A. | 离子半径:S2->Na+ | B. | 热稳定性:HCl>HF | ||
| C. | 酸性:H3BO3>H2CO3 | D. | 碱性:Al(OH)3>Ca(OH)2 |
分析 A.电子层越多,离子半径越大;
B.非金属性越强,氢化物越稳定;
C.非金属性越强,最高价含氧酸的酸性越强;
D.金属性越强,最高价氧化物的水化物碱性越强.
解答 解:A.电子层越多,离子半径越大,则离子半径:S2->Na+,故A正确;
B.非金属性F>Cl,氢化物热稳定性:HCl<HF,故B错误;
C.非金属性C>B,最高价含氧酸的酸性为H3BO3<H2CO3,故C错误;
D.金属性Ca>Al,最高价氧化物的水化物碱性为Al(OH)3<Ca(OH)2,故D错误;
故选A.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
1.下列描述的一定是金属元素的是( )
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有13个质子的元素 |
19.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
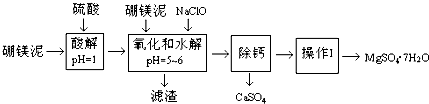
根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为D.A.10mLB.20mLC.50mLD.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+,如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤蒸发浓缩(结晶).“操作I”是将滤液继续蒸发浓缩,冷却结晶,趁热过滤,便得到了MgSO4•7H2O.
(6)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,则MgSO4•7H2O的产率为70%.

根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为D.A.10mLB.20mLC.50mLD.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+,如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,则MgSO4•7H2O的产率为70%.
6.下列各组元素性质递变情况正确的是( )
| A. | Fe、Cu、Zn原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl第一电离能依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
16.下列说法正确的是( )
| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
3.如表中关于物质分类的正确组合是( )
| 类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
| A | CO2 | CuO | 氨气 | NH3•H2O | 葡萄糖 |
| B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
| C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
| D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
| A. | A | B. | B | C. | C | D. | D |
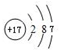 .
.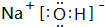 ,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程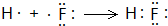 .
. .
.

 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.