题目内容
8.植物精油具抗菌消炎、解热镇痛之功效.从樟科植物叶中提取的精油中含有甲、乙、丙三种成分.I、甲经下列过程可转化为乙:

(1)乙的结构简式为
 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应.(2)对比甲乙的结构简式,简述上述过程由甲合成乙的设计意图将甲中的羟基氧化为醛基,同时又保护了碳碳双键不被氧化.
II、通过下列合成路线由乙可得丙(部分反应产物略去):
已知下列信息:①RCH=CHR′
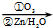 RCHO+R′CHO
RCHO+R′CHO②丙的分子式为C16H14O2,能与溴水、NaOH溶液反应.
(3)B→C的反应类型是加成反应;D中的官能团名称是碳碳双键和羧基.
(4)乙与新制Cu(OH)2悬浊液反应的化学方程式为
 .
.(5)写出同时符合下列要求的D的同分异构体的结构简式
 .
.a.属于二取代苯 b.分子中有不同化学环境的氢原子5种,其个数比为1:1:2:2:2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应.
分析 I.甲与HCl发生加成反应生成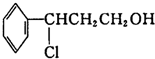 ,
,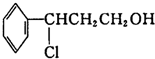 发生氧化反应生成Y为
发生氧化反应生成Y为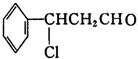 ,Y发生消去反应生成乙为
,Y发生消去反应生成乙为 ;
;
II.乙和臭氧氧化反应生成 与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为
与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为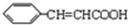 ,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为
,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为 ,
,
则A为OHC-CHO,B与氢气发生加成反应生成C为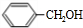 ,丙的结构简式为
,丙的结构简式为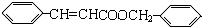 ,据此解答;
,据此解答;
解答 解:I.甲与HCl发生加成反应生成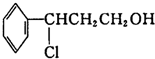 ,
,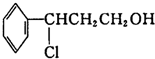 发生氧化反应生成Y为
发生氧化反应生成Y为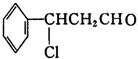 ,Y发生消去反应生成乙为
,Y发生消去反应生成乙为 ;
;
(1)乙的结构简式为 ,苯环、碳碳双键、醛基均与氢气发生加成反应,1mol乙最多可与 5mol H2反应,
,苯环、碳碳双键、醛基均与氢气发生加成反应,1mol乙最多可与 5mol H2反应,
故答案为: ;5;
;5;
(2)对比甲乙的结构简式,简述上述过程由甲合成乙的设计意图为将甲中的羟基氧化为醛基,同时又保护了碳碳双键不被氧化,
故答案为:将甲中的羟基氧化为醛基,同时又保护了碳碳双键不被氧化;
II.乙和臭氧氧化反应生成 与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为
与OHC-CHO,乙和新制氢氧化铜悬浊液发生氧化反应然后酸化得到D,D的结构简式为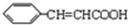 ,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为
,丙的分子式为C16H14O2,能与溴水、NaOH溶液反应,说明丙中有碳碳不饱和键和酯基,结合丙的分子式中碳原子数目可知,可知B为 ,则A为OHC-CHO,B与氢气发生加成反应生成C为
,则A为OHC-CHO,B与氢气发生加成反应生成C为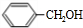 ,丙的结构简式为
,丙的结构简式为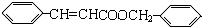 ,
,
(3)B→C是醛与氢气在催化剂、加热条件下发生的加成反应,D的结构简式为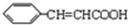 ,D中的官能团名称是碳碳双键和羧基,
,D中的官能团名称是碳碳双键和羧基,
故答案为:加成反应;碳碳双键和羧基;
(4)乙与新制Cu(OH)2反应的化学方程式为: ,
,
故答案为: ;
;
(5)同时符合下列要求的D(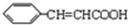 )的同分异构体的结构简式:a.属于二取代苯;b.分子中有5种不同环境的氢原子,其个数比为1:2:2:1:2;c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应,含有酯基、碳碳双键,该同分异构体结构简式为:
)的同分异构体的结构简式:a.属于二取代苯;b.分子中有5种不同环境的氢原子,其个数比为1:2:2:1:2;c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应,含有酯基、碳碳双键,该同分异构体结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物推断及合成、有机反应类型、同分异构体书写等,注意根据有机物的结构与反应条件进行推断,关键是熟练掌握各种官能团结构和性质,有助于培养学生的逻辑推理能力和发散思维能力,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案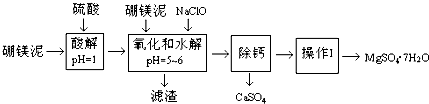
根据题意回答第(1)~(6)题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为D.A.10mLB.20mLC.50mLD.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+,如果溶液变红色,说明滤液中含Fe3+.
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,则MgSO4•7H2O的产率为70%.
| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
| 类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
| A | CO2 | CuO | 氨气 | NH3•H2O | 葡萄糖 |
| B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
| C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
| D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
| A. | A | B. | B | C. | C | D. | D |
②N2(g)+3H2(g)=2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 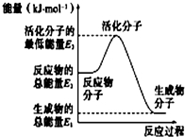 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(2)基态C原子的电子排布式为1s22s22p63s2.第一电离能:A>B(填“>”或“<”“=”).
(3)A、B、D电负性由大到小的顺序为O>N>Si(用元素符号表示).
(4)D和A形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于原子晶体.
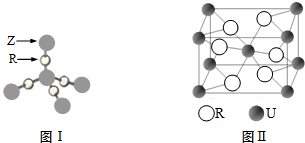
(5)E元素与A元素形成某种化合物的晶胞结构如图所示(黑球代表E原子),若该晶体的密度为ρg•cm-3,则该晶胞的体积是$\frac{206}{ρ{N}_{A}}$cm3.
 .
.