题目内容
20.化学反应方程式的理解注重反应过程的研究.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CO2+NH3+H2O═NH4HCO3 | D. | 2Na2O2+2CO2═2Na2CO3+O2↑ |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,同时有离子键,极性共价键和非极性共价键的断裂和形成,说明有离子化合物参加和生成,据此分析解答.
解答 解:A.该反应中没有非极性共价键生成,故A错误;
B.该反应中没有离子键断裂,故B错误;
C.该反应中没有离子键断裂,没有非极性共价键的断裂和生成,故C错误;
D.该反应中过氧化钠中离子键及非极性共价键、二氧化碳中极性共价键都发生断裂,氧气中非极性共价键、碳酸钠中离子键和极性共价键生成,有离子键、极性共价键和非极性共价键的断裂和形成,故D正确;
故选D.
点评 本题考查了化学键的判断,明确物质构成及微粒间的作用力是解本题关键,注意过氧化钠电子式的书写,题目难度不大.

练习册系列答案
相关题目
10.下列有关叙述正确的是( )
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 分子组成上相差一个或若干个“CH3”原子团的两种有机物必定互为同系物 | |
| D. | 相对分子质量相等的两种有机物必定是同分异构体 |
11.为了检验某FeCl2溶液是否氧化变质,可向溶液中加入( )
| A. | NaOH 溶液 | B. | 铁片 | C. | 石蕊溶液 | D. | KSCN溶液 |
8.允许用一种试剂鉴别溴苯、苯和乙酸,最好选用( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 蒸馏水 | D. | 乙醇 |
15.下列分子中含有的电子总数最少的是( )
| A. | CO | B. | H2O | C. | NO | D. | O2 |
9.关于苯的结构和性质叙述中,不正确的是( )
| A. | 苯可以用作有机溶剂 | |
| B. | 苯分子的结构简式可表示为 | |
| C. | 苯是单键与双键交替组成的环状结构 | |
| D. | 苯燃烧时能产生大量黑烟 |
10. 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:
ClO3-+3HSO3-═3SO42-+Cl-+3H+
已知该反应的速率随c(H+)的增大而加快.
下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+
已知该反应的速率随c(H+)的增大而加快.
下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合 | |
| C. | 纵坐标为v(H+)的v-t曲线与图中曲线完全重合 | |
| D. | 后期反应速率下降的主要原因是反应物浓度减小 |
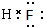 ;
;