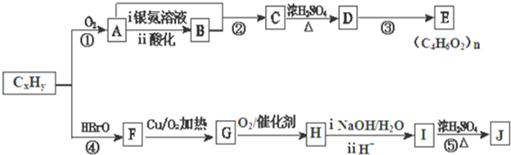
题目内容
10.下列有关叙述正确的是( )| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 分子组成上相差一个或若干个“CH3”原子团的两种有机物必定互为同系物 | |
| D. | 相对分子质量相等的两种有机物必定是同分异构体 |
分析 A.煤的干馏是煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程;
B.金属与非金属元素分界线附近的元素,具有金属性与非金属性;
C.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
D.同分异构体分子式相同、结构不同.
解答 解:A.石油分馏是分离几种不同沸点的混合物的一种方法,属于物理变化,煤的干馏是煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,属于化学变化,故A错误;
B.金属与非金属元素分界线附近的元素,具有金属性与非金属性,则元素可作半导体材料,故B正确;
C.分子组成上相差一个“CH2”原子团的两种有机物,如结构不同,则一定不是同系物,如环烷烃和烯烃,故C错误;
D.相对分子质量相等的两种有机物分子式不一定相同,如甲酸和乙醇,故D错误;
故选B.
点评 本题考查物质的分离,有机物的结构和性质,侧重于同系物和同分异构体的理解,注意能举出反例.

练习册系列答案
相关题目
6.能说明镁比铝还原性强的事实是( )
| A. | 镁原子的价电子数比铝少 | |
| B. | 镁遇冷浓硝酸和硫酸,表面不能钝化,而铝均能 | |
| C. | 镁带能在空气中和在盛CO2的集气瓶里燃烧,而铝箔均不能 | |
| D. | 铝的硬度、延展性、熔点均比镁大、好、高 |
1.某无色透明溶液中可能含有以下离子中的若干种K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、CO32-、I-和Cl-,取该溶液进行如下实验:
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断原溶液中( )
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断原溶液中( )
| A. | ②中无色气体中有NO,可能含CO2 | |
| B. | ③中沉淀有BaSO4,可能含BaCO3 | |
| C. | 肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+、Cl- | |
| D. | ②中红棕色气体通入水中发生反应的离子方程式为:3NO2+H2O═H++NO3-+2NO |
5.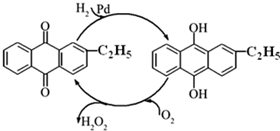 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是过氧化氢具有强氧化性.
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用图表示,此过程中与Pd起相同作用的物质为乙基蒽醌 (写名称).
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
①实验I、Ⅱ研究对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为1.0moL•L-1.
②三组实验中分解速率最慢的是Ⅰ(填编号).
m.过氧化氢含量的实验测定
兴趣小组同学用0.1000moL•L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(4)滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色.
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示.
计算试样中过氧化氢的浓度为0.180 moL•L-1 (保留三位有效数字).
 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是过氧化氢具有强氧化性.
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用图表示,此过程中与Pd起相同作用的物质为乙基蒽醌 (写名称).
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中.
| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
②三组实验中分解速率最慢的是Ⅰ(填编号).
m.过氧化氢含量的实验测定
兴趣小组同学用0.1000moL•L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(4)滴定到达终点的现象是锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色.
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4 标准溶液体积如下表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
2.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)?N(g)+H2(g).
①该反应的平衡常数为1.该温度下,向容器中充入2molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正>V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是ABD.
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.8.
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
②结合表中数据判断下列说法中正确的是ABD.
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.8.
20.化学反应方程式的理解注重反应过程的研究.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CO2+NH3+H2O═NH4HCO3 | D. | 2Na2O2+2CO2═2Na2CO3+O2↑ |