题目内容
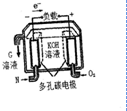 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:(1)元素E在元素周期表中的位置是
(2)①A、B两种元素能形成两种常温下呈气态的化合物M、N,其中M能引起大气温室效应,写出C单质与M反应的化学方程式:
②N用来制成燃料电池(如图),写出负极的电极反应式:
③G的水溶液能使酚酞溶液显红色,用离子方程式分析原因:
(3)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:D原子的最外层电子数是A原子内层电子数的3倍又是C原子最外层电子数的3倍,故A和C的内层电子数和最外层电子数为1或者2,那么D原子最外层电子数为3或6,若A内层为1,则A为H,那么D原子的最外层电子数=12-1-1=10,错误,故A的内层为2,即D的最外层为6,那么依据B、D同主族,即B为O,D为S,E只能为Cl,那么A的最外层为:12-2-6=4,C、D、E位于同一周期,故C是Mg,综合以上分析:A为C,B为O,C为Mg,D为S,E为Cl,据此解答各小题即可.
解答:
(1)E为Cl,位于第三周期ⅦA族,AD2是CS2,属于共价化合物,故其电子式为: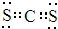 ,故答案为:第三周期ⅦA族;
,故答案为:第三周期ⅦA族;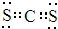 ;
;
(2)①二氧化碳与镁反应生成氧化镁和碳,故化学反应方程式为:2Mg+CO2═2MgO+C,故答案为:2Mg+CO2
2MgO+C; ②一氧化碳失去电子,在碱性溶液中形成碳酸根,故负极的电极方程式为:CO-2e-+4OH-=CO32-+2H2O,故答案为:CO-2e-+4OH-=CO32-+2H2O;
③碳酸根水解呈碱性,故碳酸根的溶液呈碱性,离子反应方程式为:CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)O3、Cl2和ClO2具有强氧化性,均能杀菌消毒,故答案为:O3、Cl2.
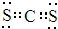 ,故答案为:第三周期ⅦA族;
,故答案为:第三周期ⅦA族;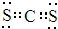 ;
;(2)①二氧化碳与镁反应生成氧化镁和碳,故化学反应方程式为:2Mg+CO2═2MgO+C,故答案为:2Mg+CO2
| ||
③碳酸根水解呈碱性,故碳酸根的溶液呈碱性,离子反应方程式为:CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(3)O3、Cl2和ClO2具有强氧化性,均能杀菌消毒,故答案为:O3、Cl2.
点评:本题主要考查的是元素化合物的推断,抓住关键词“倍数关系”“和差关系”是解决问题的关键.

练习册系列答案
相关题目
下列离子方程式与所述事实相符且正确的是( )
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
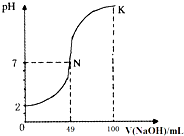 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
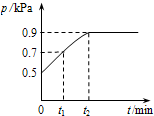 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )A、从反应开始到t1时的平均反应速率v(X)=
| ||
| B、该温度下此反应的平衡常数K=0.32 | ||
| C、欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | ||
| D、其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
在稀醋酸溶液中,欲使醋酸电离平衡右移且氢离子浓度增大,应采取的措施是( )
| A、加入NaOH | B、加入盐酸 |
| C、加水 | D、升高温度 |

 为碳原子,
为碳原子, 为硅原子).每个碳原子周围与其距离最近的硅原子有
为硅原子).每个碳原子周围与其距离最近的硅原子有