题目内容
9.下列反应中属于放热反应而且是氧化还原反应的是( )| A. | 铝粉与氧化铁粉末反应 | B. | 强酸与强碱的中和反应 | ||
| C. | 碳酸钙受热分解 | D. | 氧化钙溶于水 |
分析 含元素化合价变化的反应,为氧化还原反应;反应物总能量大于生成物总能量,则反应为放热反应,以此来解答.
解答 解:A.铝粉与氧化铁粉末反应生成铁和氧化铝,为铝热反应,有元素的化合价变化,为氧化还原反应,且为放热反应,故A选;
B.强酸与强碱的中和反应,没有元素的化合价变化,为非氧化还原反应,且为放热反应,故B不选;
C.碳酸钙受热分解生成氧化钙和二氧化碳,没有元素的化合价变化,为非氧化还原反应,且为吸热反应,故C不选;
D.氧化钙溶于水生成氢氧化钙,没有元素的化合价变化,为非氧化还原反应,且为放热反应,故D不选;
故选A.
点评 本题考查氧化还原反应和反应中的热效应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应、吸热反应判断的考查,注意归纳常见的放热、吸热反应及从元素化合价角度分析,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
11.茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品使用不恰当的是( )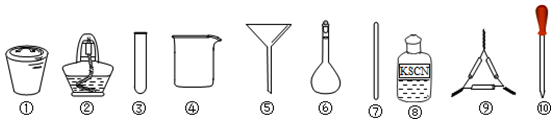

| A. | 将茶叶灼烧灰化,选用①、②、⑦和⑨ | |
| B. | 用浓硝酸溶解茶叶并加蒸馏水稀释,选用③和⑩ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验中滤液中的Fe3+,选用③、⑧和⑩ |
12.W、X、Y、Z是原子序数依次增大的短周期主族元素,W的氢化物常用作制冷剂,W与Y最外层电子数之和与X最外层电子数相等,Z最外层电子数等于最内层电子数.下列说法正确的是( )
| A. | Y的最高价氧化物对应水化物的碱性比Z的弱 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | Y3W与YW3中的化学键类型相同 |
9.利用合成气(主要成分为CO、CO2和H2)通过下列反应合成甲醇.下列说法正确的是( )
反应①:CO2(g)+H2(g)?CO(g)+H2O(g)△H1=41kJ•mol-1
反应②:CO(g)+2H2(g)?CH3OH(g)△H2=-99kJ•mol-1
反应③:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H3.
反应①:CO2(g)+H2(g)?CO(g)+H2O(g)△H1=41kJ•mol-1
反应②:CO(g)+2H2(g)?CH3OH(g)△H2=-99kJ•mol-1
反应③:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H3.
| A. | 反应①为放热反应 | B. | 增大反应①的压强,H2转化率提高 | ||
| C. | 反应②使用催化剂,△H2不变 | D. | △H3=-58 KJ•mol-1 |
4.T1℃时.在2L的密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡,反应过程中部分数据见下表.下列说法正确的是( )
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
| A. | 达到平衡时,反应Ⅰ、Ⅱ对比,平衡常数:K(Ⅰ)>K(Ⅱ) | |
| B. | 对于反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1 | |
| C. | 对于反应Ⅰ,若30min时只改变温度为T2℃,再次达到平衡时H2的物质的量为3.2mol,则T1>T2 | |
| D. | 对于反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡正向移动 |
18.已知NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,0.1NA个NH3分子的质量为1.7g | |
| B. | 标准状况下,1mol氟化氢的体积为22.4L | |
| C. | 2.4g金属镁转化为镁离子时失去的电子数目为0.1NA | |
| D. | 1L 1mol/L NaCl溶液中含有的离子总数为NA |
19.下列说法正确的是( )
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖  的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的  最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
 在容积恒定为2L的密闭容器内通入0.8mol H2和一定量的I2(g),一定温度下发生反应:H2 (g)+I2(g)═2HI(g),反应中各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去.
在容积恒定为2L的密闭容器内通入0.8mol H2和一定量的I2(g),一定温度下发生反应:H2 (g)+I2(g)═2HI(g),反应中各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去.