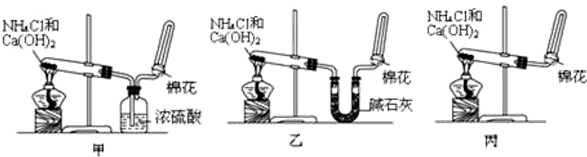
题目内容
18.常温下,有浓度均为0.5mol•L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水.请根据题目要求回答下列问题:(1)上述溶液中,可发生水解反应的是①②(填序号,下同),在发生水解反应的溶液中pH最大的是①.
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是②.
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$的值减小(填“增大”,“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-).
分析 (1)含有弱离子的盐都能发生水解;弱酸根离子水解程度越大其盐溶液的pH越大;
(2)弱酸的酸式盐既能与氢氧化钠溶液反应,又能与硫酸溶液反应;
(3)取适量溶液④,加入少量氯化铵固体,铵根离子浓度增大,抑制一水合氨电离;
(4)将等体积、等浓度的③和④的溶液混合后,二者恰好反应生成氯化铵,溶液呈酸性,再结合电荷守恒判断所得溶液中离子浓度大小顺序.
解答 解:(1)Na2CO3、NaHCO3都含有弱离子,所以都能发生水解;碳酸根离子水解程度远远大于碳酸氢根离子,所以相同浓度的Na2CO3、NaHCO3溶液中,pH最大的是Na2CO3,
故答案为:①、②;①;
(2)NaHCO3既能与氢氧化钠溶液反应、又能与硫酸溶液反应生成盐和水,故答案为:②;取适量溶液④,加入少量氯化铵固体,铵根离子浓度增大,抑制一水合氨电离,溶液中c(OH-)减小、c(NH3.H2O)增大,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$的值减小,
故答案为:减小;
(4)将等体积、等浓度的③和④的溶液混合后,二者恰好反应生成氯化铵,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(NH4+)<c(Cl-),盐类水解较微弱,所以c(NH4+)>c(H+),则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评 本题考查了盐类水解,明确盐的类型及盐类水解的影响因素即可解答,再结合电荷守恒来分析解答,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
4.对于平衡体系:aA(g)+bB(g)?cC(g)+dD(s)△H<0,下列判断中正确的是( )
| A. | 若(a+b)<(c+d),则反应一定能自发向右进行 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比也为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量大于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
5.关于下列各图的叙述,正确的是( )
| A. | 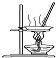 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. |  图装置可用于收集H2、NH3、NO等气体 | |
| C. | 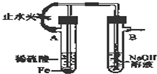 图装置能较长时间观察到Fe(OH)2白色沉淀 | |
| D. |  图能比较MnO2、Cl2、I2的氧化性 |
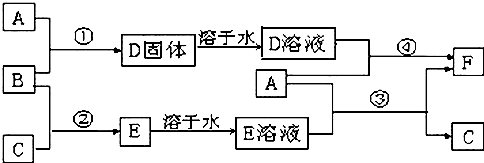
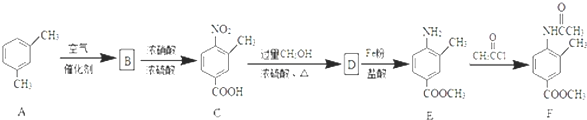
 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
.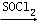 RCOCl.请写出以CH3CH2OH、
RCOCl.请写出以CH3CH2OH、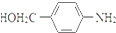 为原料,制备化合物
为原料,制备化合物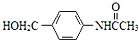 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2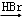 CH3CH2Br
CH3CH2Br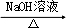 CH3CH2OH.
CH3CH2OH. .
. .
.