题目内容
3.甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题: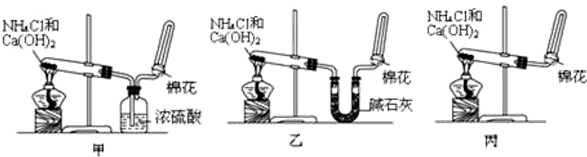
①制取氨气的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作都正确),你认为没有收集到氨气的同学是甲(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是2NH3+H2SO4=(NH4)2SO4(用化学方程式表示);
③检验氨气是否收集满的方法是(简述操作方法、现象和结论)将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满).
分析 实验室用氯化铵和氢氧化钙在加热条件下制备氨气,发生2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氨气为碱性气体,易与酸反应,可用碱石灰干燥,氨气密度比空气小,用向下排空法收集,且氨气的水溶液呈碱性,一般可用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒检验,以此解答该题.
解答 解:①加热氯化铵和氢氧化钙固体生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②甲同学用浓硫酸干燥氨气,氨气为碱性气体,能够与硫酸反应生成硫酸铵,方程式:2NH3+H2SO4=(NH4)2SO4,所以甲同学不能收集到气体;
故答案为:甲;2NH3+H2SO4=(NH4)2SO4;
③氨气的检验方法为:将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
故答案为:将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满).
点评 本题综合考查了氨气的制取、干燥及收集,为高频考点,侧重于学生的分析、实验能力的考查,注意根据氨气的性质选取干燥剂,根据氨气的溶解性及密度确定收集方法,知道形成喷泉实验的条件,并不是只有氨气才能形成喷泉实验,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.X、Y、Z、W是元素周期表中前四周期原子序数依次增大的四种元素,其相关信息如表:
(1)W位于元素周期表第四周期IB族,其基态原子核外有1个未成对电子.
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为I1(Mg)>I1(Al)>I1(Na)[用I1(元素符号)表示];Y的氢化物在同族的氢化物中沸点反常,其原因是水分子间存在氢键.
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目: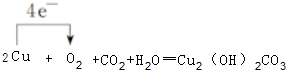 .
.
(4)在X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,写出其中一种分子的名称:乙醇.X、Y可以形成多种弱酸根离子,写出其中一种离子水解的离子方程式:CO32-+H2O??HCO3-+OH-.
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的三倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为I1(Mg)>I1(Al)>I1(Na)[用I1(元素符号)表示];Y的氢化物在同族的氢化物中沸点反常,其原因是水分子间存在氢键.
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目:
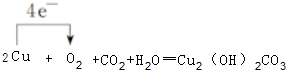 .
.(4)在X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,写出其中一种分子的名称:乙醇.X、Y可以形成多种弱酸根离子,写出其中一种离子水解的离子方程式:CO32-+H2O??HCO3-+OH-.
11.将0.04 mol/L的HCl溶液与0.08 mol/L的NaHS溶液等体积混合,所得溶液的pH<7,则下列说法正确的是( )
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
8.根据下列实验设计及有关现象,所得结论正确的是( )
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B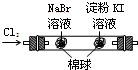 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D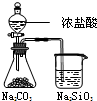 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
9.下列说法正确的是( )
| A. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| B. | 吸热且熵减的非自发反应在一定条件下也可以发生 | |
| C. | 浓硝酸具有强氧化性,常温下能够溶解铁 | |
| D. | 加过量难溶电解质MnS可除去MnCl2溶液中混有的Cu2+,说明MnS的溶解度小于CuS |
10.下列离子方程式中,正确的( )
| A. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 在H2SO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
 .
. HSO3-+OH-(用离子方程式表示).
HSO3-+OH-(用离子方程式表示).