题目内容
13.最容易形成阳离子的元素是( )| A. | K | B. | Na | C. | F | D. | Cl |
分析 金属的金属性越强,其失电子能力越强,则该元素越易形成阳离子,非金属的非金属性越强,该元素越易得电子而易形成阴离子,据此分析解答.
解答 解:金属的金属性越强,其失电子能力越强,则该元素越易形成阳离子,非金属的非金属性越强,该元素越易得电子而易形成阴离子,这几种元素中金属性K>Na、非金属性F>Cl,所以K易形成阳离子、F易形成阴离子,
故选A.
点评 本题考查元素得失电子难易程度判断,为高频考点,明确金属性、非金属性强弱判断方法是解本题关键,会根据原子结构判断元素性质,题目难度不大.

练习册系列答案
相关题目
3.下列叙述正确的是( )
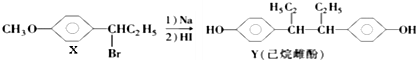
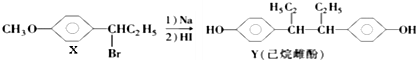
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与Br2发生加成反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
4.下列说法正确的是( )
| A. | 该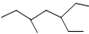 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. | 该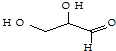 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol |
1.下列依据相关实验得出的结论正确的是( )
| A. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,证明该溶液中一定不含有K+ | |
| B. | 将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 | |
| C. | 向无色溶液中加入氯水,再加CCl4,振荡静置后CCl4层呈紫色,则原溶液中含I- | |
| D. | 向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
8.下列反应属于吸热反应的是( )
| A. | 铝片与硫酸的反应 | |
| B. | 氢气在氧气中燃烧 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
18.已知,在2min内某反应物的浓度由3mol/L变成1.5mol/L,则在这段时间内该反应物的化学反应速率为( )
| A. | 3mol/(L•min) | B. | 2mol/(L•min) | C. | 1.5mol/(L•min) | D. | 0.75mol/(L•min) |
5.下列物质的性质比较,正确的是( )
| A. | 原子半径:O>N>C | B. | 碱性:LiOH>NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
3.X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
(1)Y位于元素周期表第三周期第VIA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写最高价氧化物对应的水化物的化学式).
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式: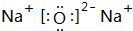 、
、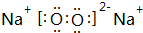 ;
;
(3)用电子式表示Y和 W形成离子化合物的过程 写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式:
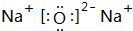 、
、 ;
; (3)用电子式表示Y和 W形成离子化合物的过程
 写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.