题目内容
14.一定质量的CH4完全燃烧后得到的产物是CO、CO2和 H2O,此混合物的质量为49.6g,通过足量的浓硫酸时减少质量25.2g,若将此混合气体通过澄清石灰水溶液,最多可得到沉淀质量为( )| A. | 30g | B. | 40g | C. | 70g | D. | 80g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,根据碳守恒,从而求沉淀的质量.
解答 解:产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,
所以n(H2O)=$\frac{25.2g}{18g/mol}$=1.4mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.4mol=0.7mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,
所以m(CO)+m(CO2)=49.6g-25.2g=24.4g,
所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,
解之:n(CO2)=0.3mol,
所以可得到沉淀质量为0.3mol×100g/mol=30g,
故选A.
点评 本题考查混合物的计算,难度中等,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 该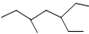 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. | 该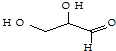 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol |
5.下列物质的性质比较,正确的是( )
| A. | 原子半径:O>N>C | B. | 碱性:LiOH>NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
9.下列有关说法不正确的是( )
| A. | 油脂在碱性条件下水解又可称为皂化反应 | |
| B. | 甲醛和硫酸铵溶液均能使蛋白质变性 | |
| C. | 标准状况下,22.4 L乙烯质量为28 g | |
| D. | 1 mol 甲基所含电子数为9NA |
19.下列说法正确的是( )
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 1-氯丙烷和2-氯丙烷的消去产物相同 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 | |
| D. | 利用油脂在酸性条件下水解,可以生产甘油和肥皂 |
6.关于原子轨道的说法正确的是( )
| A. | 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 | |
| B. | CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的 | |
| C. | 乙炔分子中,两个碳原子均采用sp2杂化轨道成键 | |
| D. | sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相等的新轨道 |
3.X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
(1)Y位于元素周期表第三周期第VIA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写最高价氧化物对应的水化物的化学式).
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式: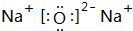 、
、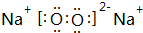 ;
;
(3)用电子式表示Y和 W形成离子化合物的过程 写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
(2)W可以生成两种氧化物,分别写出这两种氧化物的电子式:
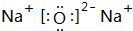 、
、 ;
; (3)用电子式表示Y和 W形成离子化合物的过程
 写出X元素的最高价氧化物的电子式
写出X元素的最高价氧化物的电子式 .
.
4.下列装置在有能量变化,其中是由化学能转变为电能的是( )
| A. |  锂离子电池 | B. |  水力发电 | ||
| C. |  硅太阳能电池 | D. |  电解水 |