题目内容
19.NaHS溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为( )| A. | S2-+Cu2+→CuS↓ | B. | 2HS-+Cu2+→CuS↓+2H++S2- | ||
| C. | HS-+Cu2+→CuS↓+H+ | D. | 2HS-+Cu2+→CuS↓+H2S↑ |
分析 HS-在溶液中电离出H+、S2-,S2-与CuSO4电离出Cu2+反应生成不溶于强酸的CuS沉淀,当硫酸铜少量时,反应生成CuS↓、H2S↑;当硫酸铜足量时,反应生成CuS↓、H+,据此进行解答.
解答 解:HS-在溶液中电离出H+、S2-,S2-与CuSO4电离出Cu2+反应生成不溶于强酸的CuS沉淀,
当硫酸铜少量时,反应生成CuS↓、H2S↑,反应的离子方程式为:2HS-+Cu2+→CuS↓+H2S↑;
当硫酸铜足量时,反应生成CuS↓、H+,反应的离子方程式为:HS-+Cu2+→CuS↓+H+,
故选CD.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
9.下列反应的离子方程式正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Cu+Fe 3+ | |
| B. | 铜与稀硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
10.PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+.取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液.下列说法错误的是( )
| A. | 上述实验中不能用盐酸代替硫酸 | |
| B. | 将试管充分振荡后静置,溶液颜色变为紫色 | |
| C. | 在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 | |
| D. | 若硫酸锰充分反应,消耗PbO2的物质的量为0.01mol |
7.R分子的质量为a g,相对质量为M,则M与a的比值等于( )
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
14.某乙醛中混有少量乙醇,要分析该乙醛的纯度,取样,进行以下定量分析,其中不合理的是( )
| A. | 测定蒸气的摩尔体积 | |
| B. | 与银氨溶液反应,分析产生银的量 | |
| C. | 与钠反应,分析产生氢气的量 | |
| D. | 用酸性高锰酸钾溶液滴定,分析相关数据 |
4.青蒿素结构如图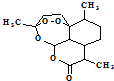 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).
a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应: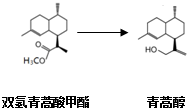
常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇.
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应:

常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
11.元素周期表中氧元素的数据见如图,说法正确的是( )
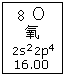

| A. | 氧元素的质量数是16 | |
| B. | 氧元素的相对原子质量是16.00 | |
| C. | 氧原子2p亚层有一个未成对电子 | |
| D. | 氧原子最外层有6个能量相同的电子 |
8.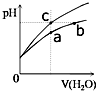 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、b、c三点溶液的离子浓度之和a>b>c | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |