题目内容
14.某乙醛中混有少量乙醇,要分析该乙醛的纯度,取样,进行以下定量分析,其中不合理的是( )| A. | 测定蒸气的摩尔体积 | |
| B. | 与银氨溶液反应,分析产生银的量 | |
| C. | 与钠反应,分析产生氢气的量 | |
| D. | 用酸性高锰酸钾溶液滴定,分析相关数据 |
分析 A.根据气体的摩尔体积,可以求算气体的摩尔质量;
B.乙醛能与银氨溶液反应,乙醇不与银氨溶液反应;
C.乙醇能与钠反应产生氢气,而乙醛不能;
D.乙醇与乙醛均能使酸性的高锰酸钾溶液褪色.
解答 解:A.测定蒸气的摩尔体积,可计算出混合气体的摩尔质量,即可得到平均相对分子质量,但因乙醇和乙醛的式量只相差2,在测定误差范围内相对难以进行定量分析样品的纯度,故A错误;
B.因只有乙醛能与银氨溶液反应生成银,可分析产生银的量,进而分析样品的纯度,故B正确;
C.因只有乙醇与钠反应生成氢气,分析产生氢气的量,可知乙醇的量,进而可以分析样品的纯度,故C正确;
D.乙醇和乙醛均能使酸性高锰酸钾溶液褐色,利用消耗的高锰酸钾的物质的量和原液体混合物的质量,可分析样品的纯度,故D正确;
故答案为:A.
点评 利用乙醇和乙醛的性质选择合适的方式分析混合物的纯度,涉及银镜反应、醇的性质及氧化还原反应滴定,混合物成分分析方式的选择是解题关键,难度较大,对学生的分析问题解决问题的能力要求较高.

练习册系列答案
相关题目
4.某粒子的结构示意图为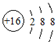 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )
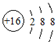 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )| A. | 核电荷数为18 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素的原子 | D. | 在化学反应中易得2个电子 |
5.下列有关物质结构的叙述正确的是( )
| A. | 在离子化合物中不可能存在非极性共价键 | |
| B. | 由电子定向移动而导电的物质一定是金属晶体 | |
| C. | 有键能很大的共价键存在的物质熔沸点一定很高 | |
| D. | 只含有共价键的物质不一定是共价化合物 |
2.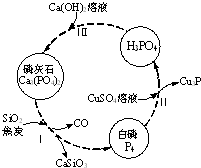 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有Ca (H2PO4)2、CaHPO4.
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
(3)磷灰石中,碳元素的质量分数为1.66%%(保留两位小数).
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4114.87g(保留两位小数).
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值.
 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有Ca (H2PO4)2、CaHPO4.
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4114.87g(保留两位小数).
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值.
9.分子式为C7H8O的芳香族化合物不可能是( )
| A. | 醇 | B. | 酚 | C. | 醚 | D. | 醛 |
19.NaHS溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为( )
| A. | S2-+Cu2+→CuS↓ | B. | 2HS-+Cu2+→CuS↓+2H++S2- | ||
| C. | HS-+Cu2+→CuS↓+H+ | D. | 2HS-+Cu2+→CuS↓+H2S↑ |
3.已知N2(g)+3H2(g)?2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( )
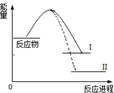

| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
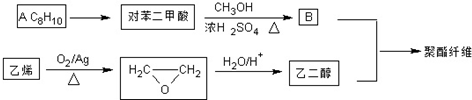
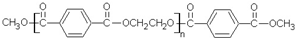 若乙二醇过量,则生成的聚酯纤维可表示为
若乙二醇过量,则生成的聚酯纤维可表示为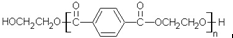 .
.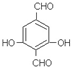 .
.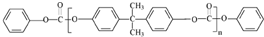 合成PC的2种单体的中:醇(或酚)的结构简式为
合成PC的2种单体的中:醇(或酚)的结构简式为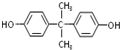 ,酯的名称为碳酸二苯酚酯.
,酯的名称为碳酸二苯酚酯.