题目内容
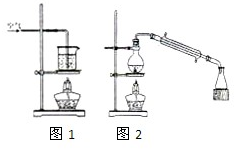 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.Ⅰ制备硫酸铜溶液
称取一定质量的铜粉放入烧杯中,加入6mol?L-1硫酸,加热并通入空气,实验装置见图1,待铜粉完全溶解后即可得硫酸铜溶液.
(1)上述制备过程中所涉及反应的离子方程式为
(2)小组经过多次实验后发现,在反应时间相同的情况下,温度应控制在70℃~90℃为最佳.若温度低于70℃,会导致铜的反应量较少,原因可能是
(3)实验时通入空气的速度不宜过慢,应能使铜粉较均匀地悬浮在溶液中,其目的是
Ⅱ获得硫酸铜晶体
(4)硫酸铜溶液中获得硫酸铜晶体的实验步骤依次为:
①蒸发浓缩、②
(5)在(4)的步骤中,加入了适量乙醇,其优点有:
①降低CuSO4的溶解度,有利于CuSO4晶体析出.
②
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:Ⅰ.铜和稀硫酸不反应,在加热条件下通入氧气,可反应生成硫酸铜和水,结合影响反应速率的因素解答该题;
Ⅱ.从溶液中获取晶体,可经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,为减少硫酸铜的溶解,可用加入少量乙醇,并用蒸馏的方法分离乙醇.
Ⅱ.从溶液中获取晶体,可经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,为减少硫酸铜的溶解,可用加入少量乙醇,并用蒸馏的方法分离乙醇.
解答:
解:Ⅰ.(1)加热条件下通入氧气,可反应生成硫酸铜和水,反应的离子方程式为2Cu+O2+4H+=2Cu2++2H2O,
故答案为:2Cu+O2+4H+=2Cu2++2H2O;
(2)若温度低于70℃,反应温度越低,速率越小,而温度过高,气体的溶解度减小,生成硫酸铜也较少,
故答案为:温度低,反应速率小;温度过高,空气在溶液中溶解度降低;
(3)实验时通入空气的速度不宜过慢,应能使铜粉较均匀地悬浮在溶液中,可增大反应物的接触面积,加快反应速率,
故答案为:增大反应物的接触面积,加快反应速率;
Ⅱ.(4)从溶液中获取晶体,可经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,
故答案为:冷却结晶;洗涤;
(5)加入了适量乙醇,混合物沸点低,可降低能耗,在蒸发浓缩的初始阶段还采用了蒸馏的方法,可起到回收乙醇的作用,
故答案为:降低能耗;回收乙醇.
故答案为:2Cu+O2+4H+=2Cu2++2H2O;
(2)若温度低于70℃,反应温度越低,速率越小,而温度过高,气体的溶解度减小,生成硫酸铜也较少,
故答案为:温度低,反应速率小;温度过高,空气在溶液中溶解度降低;
(3)实验时通入空气的速度不宜过慢,应能使铜粉较均匀地悬浮在溶液中,可增大反应物的接触面积,加快反应速率,
故答案为:增大反应物的接触面积,加快反应速率;
Ⅱ.(4)从溶液中获取晶体,可经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,
故答案为:冷却结晶;洗涤;
(5)加入了适量乙醇,混合物沸点低,可降低能耗,在蒸发浓缩的初始阶段还采用了蒸馏的方法,可起到回收乙醇的作用,
故答案为:降低能耗;回收乙醇.
点评:本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理和操作,难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
下列分子中所有的原子最外层达到8电子构型的是( )
| A、BF3 |
| B、SiH4 |
| C、SF6 |
| D、PCl3 |
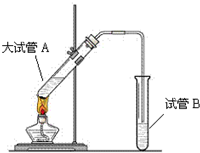 “酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.
“酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.