题目内容
12.氮可以形成多种化合物,如NO、MH3、N2H4、NO2、N2O5等.(1)己知:N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-12H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1则N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-622.2 kJ•mol-1
(2)NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)2CO2(g)+N2(g)△H=-akJ•mol-1(a>0),在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化
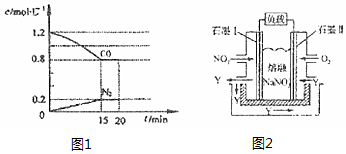
如图1所示:
①0〜15minN2的平均速率v(N2)=0.0133mol/(L•min).
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是d(选填序号).
a.缩小容器体积b.增加CO的量 c.升高温度d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将向左移动(选填“向左”、“向右”或“不”).
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I为电池的负极(正,负),电极I处产生的氧化物Y参与循环,有一部分在电极II处被利用,其利用率为50%.
分析 (1)已知①N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律可知,②-①得N2H4(l)+O2(g)=N2(g)+2H2O(l)△H;
(2)①根据v=$\frac{△c}{△t}$计算v(N2);
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
b.增加CO的量,CO的浓度增大;
c.升高温度,平衡向逆反应方向移动;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
③计算Qc与K的大小关系判断反应的移动方向;
(3)根据通入气体判断两极,写出正负极电极反应式,根据得失电子相等计算利用率.
解答 解:(1)已知①N2(g)+2H2(g)=N2H4(l)△H=+50.6kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律可知,②-①得N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=(-571.6kJ•mol-1)-(+50.6kJ•mol-1)=-622.2kJ•mol-1,
故答案为:-622.2;
(2)①由图可知,15min N2的浓度变化量为0.2mol/L,则v(N2)=$\frac{0.2mol/L}{15min}$≈0.0133mol/(L•min),
故答案为:0.0133mol/(L•min);
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a错误;
b.增加CO的量,CO的浓度增大,故b错误;
c.升高温度,平衡向逆反应方向移动,CO浓度增大,故c错误;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度减小,故d正确;
故答案为:d;
③将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,则
2CO(g)+2NO(g)?N2(g)+2CO2(g)
起始浓度(mol•L-1) 1.2 1 0 0
转化浓度(mol•L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol•L-1) 0.8 0.6 0.2 0.4
化学平衡常数K=$\frac{0.2×0.{4}^{2}}{0.{8}^{2}×0.{6}^{2}}$=0.14,
20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g)?N2(g)+2CO2(g)
瞬时浓度(mol•L-1) 0.8 0.6 0.4 0.4
Qc=$\frac{0.4×0.{4}^{2}}{0.{8}^{2}×0.{6}^{2}}$=0.556>0.14,所以平衡将向左移动,
故答案为:向左:
(3)据题意,通O2一极为正极,电极反应式为O2+2N2O5+4e-=4NO3-;通NO2一极为负极,电极反应为NO2+NO3--e-=N2O5,假设负极生成4molN2O5,根据得失电子守恒,则正极消耗2molN2O5,因此N2O5的利用率为$\frac{2mol}{4mol}$×100%=50%,
故答案为:负;50%.
点评 本题考查反应热计算、化学反应速率与平衡、化学平衡常数的计算、原电池原理等,综合性较强,为高频考点,侧重分析及计算能力的考查,把握原电池原理、电极反应为解答的关键,题目难度中等.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合:c(CH3COOH)+c(CH3COO-)=0.2mol/L |
| A. | 等浓度的下列溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2FeSO4 ④NH3•H2O,NH4+浓度大小顺序: ④>③>②>① | |
| B. | PH值相同的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,NH4+浓度大小顺序:③>②>① | |
| C. | 等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3PH大小关系:③>②>① | |
| D. | 等浓度等体积NH4Cl与NH3.H2O混合液的物量守恒:c(NH4+)+c(NH3.H2O)=c(Cl-) |
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
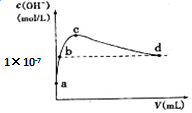 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | d点溶液中:c(Na+)═2c(CO32-)+c(HCO3-) | |
| B. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| D. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 |
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2;则△H2>△H1 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
| A. | 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | △G>0表示反应可自发 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g),△H=-571.6 kJ/mol |
| A. | S$→_{点燃}^{足量O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | SiO2$\stackrel{盐酸}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| C. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2 | |
| D. | Fe$→_{点燃}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 |