题目内容
15.25℃时下列叙述不正确的是( )| A. | pH=3的二元弱酸H2R溶液与p=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=(Na+) | |
| B. | 若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=(H+)=1×10-9mol•L-1 | |
| C. | 0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 0.1mol•L-1Na2S与0.1mol•L-1NaHS等体积混合:3c(Na+)-2c(HS-)=2c(S2-)+2c(H2S) |
分析 A.溶液混合后溶液pH=7,则c(H+)=c(OH-),结合电荷守恒判断;
B.等体积混合后得到NaY溶液,溶液的pH=9,则c(H+)=1×10-9 mol•L-1,说明HY为弱酸,生成强碱弱酸盐,根据电荷守恒和物料守恒进行解答;
C.0.2mol•L-1 HCl溶液与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,酸过量,计算出溶液中的氢离子浓度,根据pH=-lgc(H+)计算;
D.Na2S、NaHS的物质的量相等,根据物料守恒c(Na+)=$\frac{3}{2}$[c(HS-)+c(S2-)+c(H2S)].
解答 解:A.溶液混合后溶液pH=7,则c(H+)=c(OH-),溶液中电荷守恒:2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),故有2c(R2-)+c(HR-)=c(Na+),故A正确;
B.两溶液恰好反应产物为NaY,水解溶液呈碱性,由电荷守恒:c(OH-)+c(Y+)=c(H+)+c(Na+),由物料守恒:c(HY)+c(Y+)=c(Na+),联立可得:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1,故B正确;
C.混合后溶液中c(H+)=(0.2mol/L-0.1mol/L)÷2=0.05mol/L,则pH=-lg0.05=2-lg5≈1.3,故C错误;
D.溶液体积、浓度相等,则Na2S、NaHS的物质的量相等,根据物料守恒c(Na+)=$\frac{3}{2}$[c(HS-)+c(S2-)+c(H2S)],则$\frac{4}{3}$c(Na+)-2c(HS-)=2c(S2-)+2c(H2S),故D错误.
故选:CD.
点评 本题考查离子浓度的大小比较,注意从电荷守恒和物料守恒的角度分析,溶液混合时先分析溶液中的溶质,再结合电离、水解与电荷守恒、物料守恒、质子恒等式判断.

| A. | 加FeCl3溶液、分液 | B. | 加浓溴水、过滤 | ||
| C. | 加液溴反应后蒸馏 | D. | 加NaOH溶液、分液 |
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
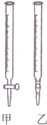 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:A.移取25.0mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准NaOH溶液润洗滴定管2~3次
C.把盛有标注NaOH溶液的滴定管固定好,挤压玻璃球,使滴定管尖嘴充满溶液
D.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面值“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,进行滴定操作到终点,并记下滴定管液面的读数
回答下列问题:
(1)如图中属于酸式滴定管的甲(选填“甲”、“乙”).
(2)正确操作步骤的顺序是BDCEAF(填字母序号).
(3)上述B步操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)判断到达滴定终点的实验现象是溶液由无色变为浅红色,且半分钟内不褪色.
(5)下列哪些操作会使测定结果偏高AC(填序号).
A.碱式滴定管用蒸馏水洗净后未用标准液润洗
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
| A. | pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(OH-)+c(M+)=c(H+)+c(A-) | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液和NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO${\;}_{3}^{-}$)-c(CO${\;}_{3}^{2-}$) | |
| C. | 等浓度、等体枳的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水,②10mL0.2mol/LMgCl2,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
| A. | 当pH=7时,若V1=V2,则一定是c2>c1 | |
| B. | 在任何情况下都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 若pH>7,则一定是c1V1>c2V2 | |
| D. | 若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
 用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )
用0.1mol•L-1NaOH溶液滴定10mL0.1mol•L-1H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法错误的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | C点:c(Na+)=c(HA-)+2c(OH-) | |
| D. | 水电离出来得c(OH-):B>D |
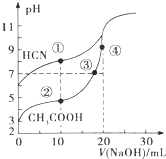
| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| A. | Br2+SO2+2H2O═H2SO4+2HBr | B. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | ||
| C. | 4NH3+5O2═4NO+6H2O | D. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 |