题目内容
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 .
(2)工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.

①在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂.
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是 .(双选)
A.容器中压强不变 B.体系的密度不随时间改变
C.v正(H2)=2v逆(CH3OH) D.CO与H2的物质的量的比不随时间改变
③计算该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数K= .
④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2).
(3)CaSO4是一种微溶物质,已知KSP(CaSO4)=9.10×10-6.现将c mol?L-1CaCl2溶液与2.00×10-2 mol?L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是 (结果保留3位有效数字).
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式
(2)工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.

①在“图1”中,曲线
②能判断该反应在“图2”所在条件下是否已达化学平衡状态的依据是
A.容器中压强不变 B.体系的密度不随时间改变
C.v正(H2)=2v逆(CH3OH) D.CO与H2的物质的量的比不随时间改变
③计算该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数K=
④请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2).
(3)CaSO4是一种微溶物质,已知KSP(CaSO4)=9.10×10-6.现将c mol?L-1CaCl2溶液与2.00×10-2 mol?L-1 Na2SO4溶液等体积混合生成沉淀,则c的最小值是
考点:热化学方程式,化学平衡状态的判断,物质的量或浓度随时间的变化曲线,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到,燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量表示热化学方程式;
(2)①根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
②CO(g)+2H2(g)?CH3OH(g).
A、该反应为反应前后压强不等的反应;利用反应前后气体体积变化来分析;
B、反应前后气体质量守恒,容器体积不变,气体密度始终不变;
C、反应速率之比等于化学方程式计量数之比是真反应速率之比;
D、CO与H2的物质的量的比和起始量有关,不随时间改变不能说明反应达到平衡;
③利用各物质平衡的浓度来计算化学平衡常数;
④根据温度和压强对该反应的影响来分析;
(5)依据沉淀溶解平衡的溶度积常数分析计算.
(2)①根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
②CO(g)+2H2(g)?CH3OH(g).
A、该反应为反应前后压强不等的反应;利用反应前后气体体积变化来分析;
B、反应前后气体质量守恒,容器体积不变,气体密度始终不变;
C、反应速率之比等于化学方程式计量数之比是真反应速率之比;
D、CO与H2的物质的量的比和起始量有关,不随时间改变不能说明反应达到平衡;
③利用各物质平衡的浓度来计算化学平衡常数;
④根据温度和压强对该反应的影响来分析;
(5)依据沉淀溶解平衡的溶度积常数分析计算.
解答:
解:(1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
依据盖斯定律①+②×2得到2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)①加入催化剂,可降低反应的活化能,由图象可知b活化能较低,应加入催化剂,故答案为:b;
②CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应;
A、该反应为反应前后压强不等的反应,压强不变说明反应达到平衡,故A符合;
B、反应前后气体质量守恒,容器体积不变,气体密度始终不变,故B不符合;
C、反应速率之比等于化学方程式计量数之比是真反应速率之比,.v正(H2)=2v逆(CH3OH)说明甲醇正逆反应速率相同,反应达到平衡,故C符合;
D、CO与H2的物质的量的比和起始量有关,不随时间改变不能说明反应达到平衡,故D不符合;
故选AC;
③从反应开始到建立平衡,平衡时:c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,则消耗n(CO)=0.75mol/L×2L=1.5mol,消耗的n(H2)=3mol,
平衡时c(H2)=
=0.5mol/L,k=
=12,
故答案为:12;
④增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低,则图象可为,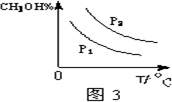
故答案为: ;
;
(3)现将c mol?L-1CaCl2溶液与2.00×10-2 mol?L-1 Na2SO4溶液等体积混合生成沉淀,溶液中c(Ca2+)=
mol/L,c(SO42-)=1.00×10-2mol/L,CaSO4是一种微溶物质,已知KSP(CaSO4)=c(Ca2+)c(SO42-)=
mol/L×1.00×10-2mol/L=9.10×10-6,c=1.82×10-3mol/L,故答案为:1.82×10-3.
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
依据盖斯定律①+②×2得到2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
CH3OH(g)+
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
(2)①加入催化剂,可降低反应的活化能,由图象可知b活化能较低,应加入催化剂,故答案为:b;
②CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应;
A、该反应为反应前后压强不等的反应,压强不变说明反应达到平衡,故A符合;
B、反应前后气体质量守恒,容器体积不变,气体密度始终不变,故B不符合;
C、反应速率之比等于化学方程式计量数之比是真反应速率之比,.v正(H2)=2v逆(CH3OH)说明甲醇正逆反应速率相同,反应达到平衡,故C符合;
D、CO与H2的物质的量的比和起始量有关,不随时间改变不能说明反应达到平衡,故D不符合;
故选AC;
③从反应开始到建立平衡,平衡时:c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,则消耗n(CO)=0.75mol/L×2L=1.5mol,消耗的n(H2)=3mol,
平衡时c(H2)=
| 4mol-3mol |
| 2L |
| 0.75 |
| 0.25×0.52 |
故答案为:12;
④增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低,则图象可为,

故答案为:
 ;
;(3)现将c mol?L-1CaCl2溶液与2.00×10-2 mol?L-1 Na2SO4溶液等体积混合生成沉淀,溶液中c(Ca2+)=
| c |
| 2 |
| c |
| 2 |
点评:本题考查了热化学方程式书写方法,化学平衡的影响因素分析判断,平衡常数计算应用,沉淀溶解平衡的溶度积计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | ||||
B、用石墨作电极电解氯化镁溶液:2Cl-+2H2O
| ||||
C、乙醛与新制的Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-
| ||||
| D、NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
在溶液中,下列各组内微粒间能发生反应的是( )
①Na+、Cl- ②Ba2+、SO42- ③H+、HCO3- ④Al3+、OH- ⑤Fe、H+.
①Na+、Cl- ②Ba2+、SO42- ③H+、HCO3- ④Al3+、OH- ⑤Fe、H+.
| A、①②③④ | B、②③④⑤ |
| C、③④⑤ | D、全部 |
NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
| B、由2H和18O所组成的水11g,其中所含的中子数为4NA |
| C、2.3 g Na和足量的O2完全反应,在常温或燃烧时,转移电子数均为0.1NA |
| D、500mL0.1mol?L-1盐酸溶液中,含有HCl分子数目为0.05 NA |
己知:含1mol CH3COOH的稀溶液与足量稀NaOH溶液反应的△H=-a kJ/mol;而含1mol HCl的稀盐酸与足量稀NaOH溶液反应的△H=-b kJ/mol.则CH3COOH(aq)?CH3COO-(aq)+H+ (aq)的△H等于( )
| A、+(b-a) kJ/mol |
| B、+( a-b ) kJ/mol |
| C、-( a+b ) kJ/mol |
| D、-( b-a ) kJ/mol |
 右图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
右图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).