题目内容
3.在3支试管中分别盛有稀硫酸、稀硝酸、稀盐酸,试设计简单的实验方案鉴别它们,写出反应的化学方程式.分析 硫酸可与氯化钡反应生成沉淀,盐酸可与硝酸银溶液反应生成氯化银沉淀,以此解答该题.
解答 解:可在3支试管中分别滴加氯化钡溶液,生成白色沉淀的为稀硫酸,发生H2SO4+BaCl2=BaSO4↓+2HCl,另外两支试管分别加热硝酸银溶液,生成白色沉淀的为稀盐酸,发生HCl+AgNO3=AgCl↓+HNO3,
答:在3支试管中分别滴加氯化钡溶液,生成白色沉淀的为稀硫酸,发生H2SO4+BaCl2=BaSO4↓+2HCl,另外两支试管分别加热硝酸银溶液,生成白色沉淀的为稀盐酸,发生HCl+AgNO3=AgCl↓+HNO3.
点评 本题考查物质的检验和鉴别,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质的异同以及实验的设计思路,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
17.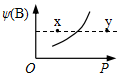 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
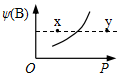 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
18.NA代表阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 常温下,100 mL 1 mol•L-1 FeCl3溶液中含有Fe3+数目小于0.1NA | |
| B. | 1 mol-OH和17 g NH3所含的电子数相等 | |
| C. | 标准状况下,2.24 L Cl2与过量铁粉反应,转移的电子总数为2NA | |
| D. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
8.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 2 L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
15.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝在下列使用场合须加以控制的是( )
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水
⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制药片治胃病 ⑨制防锈油漆.
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水
⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制药片治胃病 ⑨制防锈油漆.
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑧ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
12.实现下列变化,不需要破坏化学键的是( )
| A. | 氯化氢气体溶于水 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热氯酸钾使其分解 | D. | 氯化钠熔融 |
13.同类晶体物质熔、沸点的变化是有规律的,试分析下列两组物质熔点规律变化的原因:
晶体熔、沸点的高低,决定于组成晶体微粒间的作用力的大小.A组是①离子晶体,晶体微粒之间通过②离子键相连,粒子之间的作用力由大到小的顺序是 ③NaCl>KCl>CsCl.B组晶体属于 ④金属晶体,价电子数由少到多的顺序是 ⑤Na<Mg<Al,离子半径由大到小的顺序是 ⑥Na+>Mg2+>Al3+.金属键强度由小到大的顺序为 ⑦Na<Mg<Al.
| A组物质 | 熔点/K | B组物质 | 熔点/K |
| NaCl | 1 074 | Na | 317 |
| KCl | 1 049 | Mg | 923 |
| CsCl | 918 | Al | 933 |