题目内容
16.氨在人类的生产和生活中有着广泛的应用(1)氨气溶解于水,得到的溶液称为氨水.氨溶解于水时与水发生反应生成一水合氨(NH3•H2O),它是一种弱碱.写出一水合氨的电离方程式NH3•H2O?NH4++OH-;.从上述电离方程式可知,往氨水中加入稀硫酸生成的盐是(NH4)2SO4(填化学式)
(2)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,所得溶液的物质的量浓度为0.2mol/L.
(3)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2,利用该反应的原理,在工业上可用于检验输送氯气的管道是否漏气.该反应中,NH3是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为3mol,被氧化的物质有1mol.
分析 (1)一水合氨是一元弱碱,部分电离;一水合氨与稀硫酸反应生成(NH4)2SO4;
(2)先根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,再根据c=$\frac{n}{V}$计算所得溶液的物质的量浓度;
(3)根据反应中元素化合价的变化分析;氯气中氯元素从0价降低到-1价,1molCl2转移2mol电子.
解答 解:(1)一水合氨是一元弱碱,部分电离,其电离方程式为:NH3•H2O?NH4++OH-;一水合氨与稀硫酸反应生成(NH4)2SO4,
故答案为:NH3•H2O?NH4++OH-;(NH4)2SO4;
(2)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,则n(NH3)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则所得溶液的物质的量浓度为:c=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2;
(3)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2,反应中N元素化合价升高,则氨气为还原剂,氯气中氯元素的化合价降低,氯气为氧化剂;氯气中氯元素从0价降低到-1价,1molCl2转移2mol电子,所以1.5mol氧化剂氯气参与反应,则发生转移的电子的物质的量为3mol;当8molNH3参加反应时有2mol被氧化,转移电子为6mol,所以转移3mol电子时,被氧化的氨气为1mol,
故答案为:NH3;3;1.
点评 本题考查较为综合,涉及电离方程式书写、氧化还原反应的计算、物质的量浓度的计算等知识,题目难度中等,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 3 Cl2+6 FeI2═2FeCl3+4 FeI3 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6 HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
11.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol.
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①10min~20min以v(NO)表示的反应速率为0.012mol/(L•min).
②下列各项能判断该反应达到平衡状态的是ACE(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变 (填“增大”、“不变”或“减小”).
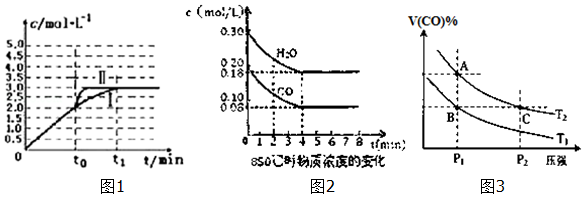
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图1中画出c(CO)随反应时间t变化的曲线.
(5)已知:CO(g)+H2O(g)H2(g)+CO2(g)?H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是B(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
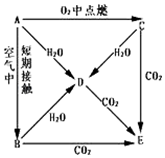
(6)图3表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol.
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
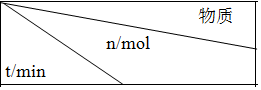 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②下列各项能判断该反应达到平衡状态的是ACE(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变 (填“增大”、“不变”或“减小”).
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图1中画出c(CO)随反应时间t变化的曲线.
(5)已知:CO(g)+H2O(g)H2(g)+CO2(g)?H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是B(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(6)图3表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),由状态B到状态A,可采用升温的方法(填“升温”或“降温”).

5.如表各组物质中,物质之间不可能实现如图X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z所示转化的是( )
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al(OH)3 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化. 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.