题目内容
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题: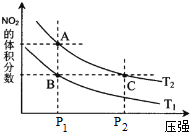
(1)已知某反应的平衡表达式为:K=
它所对应的化学反应为:
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;CO(g)+H2O(g)?H2(g)+CO2 (g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;则K1、K2、K3之间的关系是: .
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水
蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的
变化如下表所示:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: .
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是 .
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
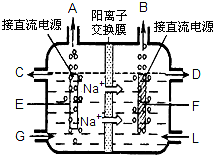
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式 .

(1)已知某反应的平衡表达式为:K=
| c(H2)c(CO) |
| c(H2O) |
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;CO(g)+H2O(g)?H2(g)+CO2 (g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;则K1、K2、K3之间的关系是:
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水
蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的
变化如下表所示:
| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式
考点:产物的百分含量随浓度、时间的变化曲线,化学平衡常数的含义,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)根据平衡常数的定义判断反应的方程式;
(2)根据平衡常数的表达式推断;
(3)温度升高K值减小,所以正反应为放热反应;令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算;
(4)从平衡移动的角度分析各物理量的变化;
(5)根据电解原理解答.阳极发生氧化反应,阴极发生还原反应,以此书写电极反应式.
(2)根据平衡常数的表达式推断;
(3)温度升高K值减小,所以正反应为放热反应;令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算;
(4)从平衡移动的角度分析各物理量的变化;
(5)根据电解原理解答.阳极发生氧化反应,阴极发生还原反应,以此书写电极反应式.
解答:
解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)根据化学方程式可知:K1=
,K2=
,K3=
,所以:K3=K1×K2,故答案为:K3=K1?K2;
(3)温度升高K值减小,所以正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
=9,解得c=0.015,
所以CO的转化率为
×100%=75%,
故答案为:放热;75%;
(4)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故A错误;
B.增大压强,平衡向正反应移动,但浓度的增大幅度大于转化的程度,所以C点浓度大,颜色深,故B错误;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.在相同压强下,升高温度,平衡向逆反应方向移动,则二氧化氮的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
E.A、C两点的化学平衡常数,温度相同,平衡常数相等,A=C,故E错误;
故答案为:D;
(5)电解NaHSO3溶液制取H2SO4,阴极是氢离子放电,由于含氧酸根的还原性比氢氧根离子强,因此阳极是氢氧根离子放电,4OH--4e-=2H2O+O2,分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体,故答案为:4OH--4e-=2H2O+O2.
(2)根据化学方程式可知:K1=
| c2(CO) |
| c(CO2) |
| c(H2)?c(CO2) |
| C(CO)?C(H2O) |
| c(CO)?c(H2) |
| c(H2O) |
(3)温度升高K值减小,所以正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
| c×c |
| (0.02-c)(0.02-c) |
所以CO的转化率为
| 0.015mol/L |
| 0.02mol/L |
故答案为:放热;75%;
(4)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故A错误;
B.增大压强,平衡向正反应移动,但浓度的增大幅度大于转化的程度,所以C点浓度大,颜色深,故B错误;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.在相同压强下,升高温度,平衡向逆反应方向移动,则二氧化氮的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
E.A、C两点的化学平衡常数,温度相同,平衡常数相等,A=C,故E错误;
故答案为:D;
(5)电解NaHSO3溶液制取H2SO4,阴极是氢离子放电,由于含氧酸根的还原性比氢氧根离子强,因此阳极是氢氧根离子放电,4OH--4e-=2H2O+O2,分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体,故答案为:4OH--4e-=2H2O+O2.
点评:本题考查化学平衡常数、平衡移动相关计算、原电池等,题目较为综合,涉及多方面的知识,难度中等,本题中注意把握等效平衡的解题应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学方程式中,不能用离子方程式H++OH-═H2O表示的是( )
| A、2NaOH+H2SO4═Na2SO4+2H2O |
| B、Ba(OH)2+H2SO4═Ba SO4↓+2H2O |
| C、KOH+HCl═KCl+H2O |
| D、Cu(OH)2+2HNO3═Cu(NO3)2+2H2O |
下列关于铝的叙述中,不正确的是( )
| A、铝是地壳里含量最多的金属元素 |
| B、在常温下,铝不能与氧气反应 |
| C、铝是一种比较活泼的金属 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料. X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.回答下列问题(相关回答均用元素符号表示):