题目内容
某校化学小组学生利用如图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置已略去)
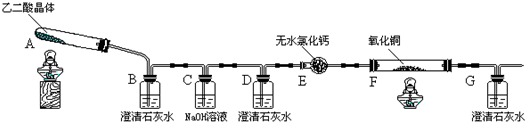
(1)装置C中盛放NaOH溶液的作用是 ;
(2)①证明分解产物中有CO2的现象是 ;
②证明分解产物中有CO的现象是 ;
(3)该装置有一个不足之处,请写出
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化,且KMnO4和草酸钠在稀硫酸中反应的离子方程式是为:MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平)
实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2680g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入最后1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作四次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的是c(KMnO4)= .

(1)装置C中盛放NaOH溶液的作用是
(2)①证明分解产物中有CO2的现象是
②证明分解产物中有CO的现象是
(3)该装置有一个不足之处,请写出
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化,且KMnO4和草酸钠在稀硫酸中反应的离子方程式是为:MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平)
实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2680g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入最后1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作四次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 | |
| 滴定管 液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL | 20.00mL |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)在后面的试验中要验证CO的存在,需要用NaOH溶液把二氧化碳除掉;
(2)①利用二氧化碳能使澄清石灰水变浑浊的性质来检验;
②利用CO和CuO反应生成二氧化碳的性质,来检验二氧化碳的存在,从而证明CO的存在;
(3)CO是大气污染物,需要吸收完全,不能直接排向空气中;
(4)第二次终点值偏大,舍弃不用,由第一、三、四次试验数据取平均值为
=20.00,假设KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
(2)①利用二氧化碳能使澄清石灰水变浑浊的性质来检验;
②利用CO和CuO反应生成二氧化碳的性质,来检验二氧化碳的存在,从而证明CO的存在;
(3)CO是大气污染物,需要吸收完全,不能直接排向空气中;
(4)第二次终点值偏大,舍弃不用,由第一、三、四次试验数据取平均值为
| 20.02+19.98+20.00 |
| 3 |
解答:
解:(1)在后面的试验中要验证CO的存在,需要用NaOH溶液把乙二酸晶体受热分解生成的二氧化碳除掉;
故答案为:吸收乙二酸晶体受热分解生成的二氧化碳;
(2)①二氧化碳通入装置B中,澄清石灰水变浑浊,说明有二氧化碳生成;
故答案为:装置B中澄清石灰水变浑浊;
②CO和CuO反应生成二氧化碳,二氧化碳使装置G中澄清石灰水变浑浊,先验证A中产生的二氧化碳被NaOH吸收完全,即装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
故答案为:装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
(3)CO是大气污染物,需要吸收完全,不能直接排向空气中,需要在G装置后加处理尾气CO的装置;
故答案为:在G装置后未处理尾气CO;
(4)第二次终点值偏大,舍弃不用,由第一、三、四次试验数据取高锰酸钾溶液体积平均值为
=20.00mL,假设KMnO4溶液的浓度为c,n(C2O42-)=
=0.002mol,则:
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
2mol 5mol
c×0.02L 0.002mol
所以2mol:5mol=c×0.02L:0.002mol
解得c=0.04000mol/L.
故答案为:0.0400mol/L.
故答案为:吸收乙二酸晶体受热分解生成的二氧化碳;
(2)①二氧化碳通入装置B中,澄清石灰水变浑浊,说明有二氧化碳生成;
故答案为:装置B中澄清石灰水变浑浊;
②CO和CuO反应生成二氧化碳,二氧化碳使装置G中澄清石灰水变浑浊,先验证A中产生的二氧化碳被NaOH吸收完全,即装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
故答案为:装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
(3)CO是大气污染物,需要吸收完全,不能直接排向空气中,需要在G装置后加处理尾气CO的装置;
故答案为:在G装置后未处理尾气CO;
(4)第二次终点值偏大,舍弃不用,由第一、三、四次试验数据取高锰酸钾溶液体积平均值为
| 20.02+19.98+20.00 |
| 3 |
| 0.2680g |
| 134g/mol |
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
2mol 5mol
c×0.02L 0.002mol
所以2mol:5mol=c×0.02L:0.002mol
解得c=0.04000mol/L.
故答案为:0.0400mol/L.
点评:本题考查已二酸的分解、化学计算等,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
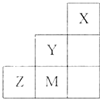

| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |
在0.1mol/L的Na2CO3溶液中,下列关系式不正确的是( )
| A、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| B、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D、c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L |
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH.则下列说法正确的是( )
| A、电解过程中阴极没有气体生成 |
| B、电解过程中转移的电子的物质的量为0.4 mol |
| C、原CuSO4溶液的浓度为0.1 mol?L-1 |
| D、电解过程中阳极收集到的气体体积为1.12 L(标况下) |
 有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-.取该溶液进行以下实验:
有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-.取该溶液进行以下实验:

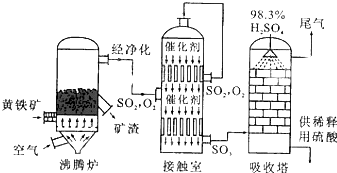 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图: