题目内容
 镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )
镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )| A、电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- |
| B、放电过程中OH-移向正极 |
| C、镁电池中镁均为负极,发生氧化反应 |
| D、镁-过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,放电时,电解质溶液中阴离子向负极移动.
解答:
解:A.镁在负极上失电子生成镁离子,次氯酸根离子在正极上得电子和水生成氯离子和氢氧根离子,所以电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,故A正确;
B.放电过程中氢氧根离子向负极移动,故B错误;
C.镁失电子发生氧化反应而作负极,故C正确;
D.酸性介质中,正极上双氧水得电子发生还原反应,电极反应式为H2O2+2H++2e-═2H2O,故D正确;
故选B.
B.放电过程中氢氧根离子向负极移动,故B错误;
C.镁失电子发生氧化反应而作负极,故C正确;
D.酸性介质中,正极上双氧水得电子发生还原反应,电极反应式为H2O2+2H++2e-═2H2O,故D正确;
故选B.
点评:本题考查了原电池原理,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )| A、X电极是阴极 |
| B、Y电极产生气体的体积为0.224L |
| C、电解后溶液的pH=1 |
| D、要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质与稀盐酸反应的速率为L>Q |
| C、M与T形成的化合物具有两性 |
| D、L2+与R2-的核外电子数相等 |
 X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )
X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )| A、X的氢化物的水溶液显碱性 |
| B、Y和Z只能组成一种化合物 |
| C、Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性 |
| D、最高价氧化物对应水化物的酸性:W>Z |
下列各组物质中,当总物质的量一定时,不论按何种比例混合,充分燃烧后,生成水的质量为一常量,且生成CO2质量也为一定值的是( )
| A、乙烷、乙醇、乙二醇 |
| B、苯、苯酚、苯乙烯 |
| C、甲醛、乙酸、甲酸甲酯 |
| D、甲烷、乙烯、乙烷 |
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出).下列有关该方法的叙述中不正确的是( )
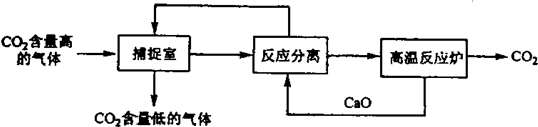

| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |