题目内容
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:在NH4Al(SO4)2溶液中逐滴加入Ba(OH)2溶液,NH4Al(SO4)2和Ba(OH)2按照2:3反应,铝离子恰好沉淀,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓;NH4Al(SO4)2和Ba(OH)2按照1:2反应,铵根离子参与反应生成一水合氨,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O,如果NH4Al(SO4)2和Ba(OH)2按照2:5反应,氢氧化铝沉淀完全溶解,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-→2BaSO4↓+2H2O+AlO2-+NH3?H2O,据此进行解答.
解答:
解:A.氨水碱性强于氢氧化铝,所以铝离子优先与氢氧根离子反应,如果铵根离子反应,铝离子一定参与反应,故A错误;
B.NH4Al(SO4)2和Ba(OH)2按照2:3反应,铝离子恰好沉淀,铵根离子没有参与反应,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓,故B正确;
C.氢氧化铝沉淀溶解之前,铵根离子先与氢氧根离子反应生成一水合氨,铵根离子完全反应后,氢氧化铝沉淀才能够溶解,故C错误;
D.当氢氧化钡过量时,铵根离子、铝离子完全反应分别生成一水合氨、偏铝酸根离子,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选BD.
B.NH4Al(SO4)2和Ba(OH)2按照2:3反应,铝离子恰好沉淀,铵根离子没有参与反应,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓,故B正确;
C.氢氧化铝沉淀溶解之前,铵根离子先与氢氧根离子反应生成一水合氨,铵根离子完全反应后,氢氧化铝沉淀才能够溶解,故C错误;
D.当氢氧化钡过量时,铵根离子、铝离子完全反应分别生成一水合氨、偏铝酸根离子,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选BD.
点评:本题考查了离子方程式的正误判断,题目难度较大,注意掌握离子方程式的书写原则,正确判断反应物的过量情况及优先与氢氧根离子反应的离子是解答本题关键.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、Fe2+、Cl-、SO42-、Na+ |
| B、NH4+、Al3+、NO3-、Cl- |
| C、Ca2+、K+、Cl-、HCO3- |
| D、K+、Na+、SO32-、SO42- |
关于CH4和 的叙述正确的是( )
的叙述正确的是( )
 的叙述正确的是( )
的叙述正确的是( )| A、通常情况下它们都是气态烷烃 |
| B、与所有烷烃互为同系物 |
| C、因为它们结构相似,所以它们的化学性质相似,物理性质相同 |
| D、均能用CnH2n+2组成通式来表示 |
 镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )
镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )| A、电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- |
| B、放电过程中OH-移向正极 |
| C、镁电池中镁均为负极,发生氧化反应 |
| D、镁-过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
图为铜锌原电池示意图,下列说法错误的是( )


| A、锌片为负极,且逐渐溶解 |
| B、铜片为正极,铜不易失电子而受到保护 |
| C、电子由锌片通过导线流向铜片,H+往铜片运动 |
| D、该装置能将电能转变为化学能 |
下列反应属于吸热反应的是( )
| A、氢氧化钠与硝酸反应 |
| B、铁与盐酸反应 |
| C、氢氧化钡与氯化铵反应 |
| D、氧化钙与水反应 |
下列离子方程式书写正确的是( )
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| D、向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2Fe+2I-+2Cl2→2Fe3++I2+4Cl- |
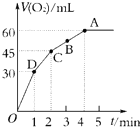 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.