题目内容
下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3?H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 .
考点:强电解质和弱电解质的概念,电解质溶液的导电性
专题:离子反应专题
分析:由物质导电的原因可知,只要含有自由移动的离子或自由电子即可;
根据强弱电解质的定义分析,完全电离的是强电解质,部分电离的是弱电解质.
根据强弱电解质的定义分析,完全电离的是强电解质,部分电离的是弱电解质.
解答:
解:①石墨是单质,既不是电解质,也不是非电解质,但能导电;
②三氧化硫是非电解质,不能导电;
③液态氯化氢是强电解质,不能导电;
④氯气是单质,既不是电解质,也不是非电解质,不能导电;
⑤熔融的硫酸钾是强电解质,能导电;
⑥食盐晶体是强电解质,不能导电;
⑦硫酸溶液是化合物,既不是电解质,也不是非电解质,但能导电;
⑧乙醇是三氧化硫是非电解质,不能导电;
⑨冰醋酸是弱电解质,不能导电;
⑩NH3?H2O是弱电解质,不能导电;
故能够导电的是 ①⑤⑦,强电解质是③⑤⑥,弱电解质是⑨⑩,
故答案为:①⑤⑦;③⑤⑥;⑨⑩.
②三氧化硫是非电解质,不能导电;
③液态氯化氢是强电解质,不能导电;
④氯气是单质,既不是电解质,也不是非电解质,不能导电;
⑤熔融的硫酸钾是强电解质,能导电;
⑥食盐晶体是强电解质,不能导电;
⑦硫酸溶液是化合物,既不是电解质,也不是非电解质,但能导电;
⑧乙醇是三氧化硫是非电解质,不能导电;
⑨冰醋酸是弱电解质,不能导电;
⑩NH3?H2O是弱电解质,不能导电;
故能够导电的是 ①⑤⑦,强电解质是③⑤⑥,弱电解质是⑨⑩,
故答案为:①⑤⑦;③⑤⑥;⑨⑩.
点评:本题考查电解质、非电解质的概念,物质的导电性,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )
镁燃料电池具有比能量高、安全方便、成本低等特点,常用的有镁-次氯酸盐燃料电池,镁-过氧化氢燃料电池等,图为镁-次氯酸盐燃料电池的工作原理图,下列说法不正确的是( )| A、电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- |
| B、放电过程中OH-移向正极 |
| C、镁电池中镁均为负极,发生氧化反应 |
| D、镁-过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
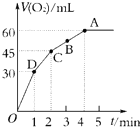 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.