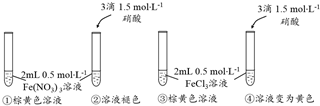
题目内容
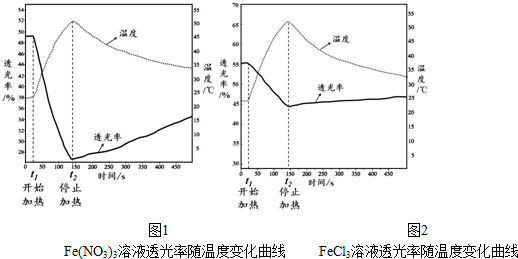
1.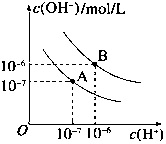 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)95℃时水的离子积KW=1.0×10-12.
(2)95℃时,0.01mol/LNaOH溶液的PH=10.
(3)95℃时水的电离平衡曲线应为B(填“A”或“B”),请说明理由水的电离是吸热过程,温度升高电离程度增大,C(H+)、C(OH-)均增大.
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为10:1.
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+pH2=14(或a+b=14).
(6)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析原因:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5.
分析 (1)横轴是氢离子浓度,纵轴是氢氧根离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算出A曲线的Kw值;
(2)根据水的离子积常数Kw=c(H+)×c(OH-)计算;
(3)95℃时水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为10-6mol/L;
(4)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(5)酸、碱都是强电解质,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定强酸的pH1与强碱的pH2之间应满足的关系;
(6)根据曲线B对应温度下pH=5,说明溶液显示酸性,反应后氢离子过量分析.
解答 解:(1)曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12 ,故答案为:1.0×10-12;
(2)95℃时,0.01mol/LNaOH溶液中氢氧根离子的浓度为0.01mol/L,所以溶液中氢离子的浓度为:10-10mol/L,所以溶液的PH=10,故答案为:10;
(3)95℃时水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为10-6mol/L,水的电离是吸热过程,温度升高电离程度增大,C(H+)、C(OH-)均增大,故选:B;水的电离是吸热过程,温度升高电离程度增大,C(H+)、C(OH-)均增大;
(4)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)•10-5 mol•L-1=V(H2SO4)•10-4 mol•L-1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(5)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH-浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即pH1+pH2=14,或a+b=14,
故答案为:pH1+pH2=14(或a+b=14);
(6)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸碱,两溶液等体积混合后溶液呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,酸过量,所以酸HA是弱酸,
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5.
点评 本题考查了水的电离平衡、水的离子积常数的影响因素以及计算等知识,注意知识的归纳和梳理是关键,难度中等.

 名校课堂系列答案
名校课堂系列答案(1)工业上可用纯碱、焦炭、氨气在高温下反应可以制取NaCN,写出反应的化学方程式Na2CO3+C+2NH3=2NaCN+3H2O.
(2)工业利用NaCN制备蓝色染料的流程如下:
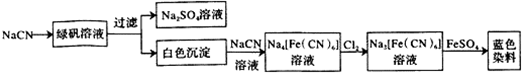
通入Cl2时发生反应的离子方程式为_2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-_,该蓝色染料的化学式为Fe3[Fe(CN)6]2.
(3)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.浸取过程的氧化剂是O2.
(4)上述方法的主要缺点是容易引起水体污染.天津“8.12“爆炸中扩散的CN-也造成了部分水体污染.某小组欲检测污水中CN-的浓度.
资料:碱性条件下发生离子反应:2CN-+5H2O2+2OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
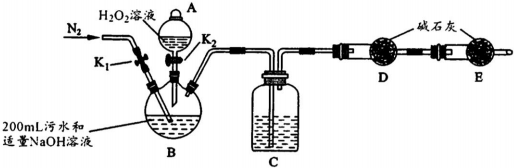
①加入药品之前的操作是检查装置气密性;B的名称是三颈瓶,C中试剂是浓H2S04.
②实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
(5)常温下HCN的电离常数Ka=6.2×10-10,浓度均为0.5mol/L的NaCN和HCN的混合溶液显碱(填“酸”、“碱”或“中”)性,通过计算说明其原因Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性.
S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
2H2(g)+O2(g)═2H2O(l)△H4.
下列大小关系正确的是( )
| A. | △H2>△H1,△H4>△H3 | B. | △H1>△H2,△H4>△H3 | C. | △H1>△H2,△H3>△H4 | D. | △H2>△H1,△H3>△H4 |
| A. | 0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L | |
| B. | 1 L该溶液中含有Na2CO3的质量为10.6 g | |
| C. | 从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L | |
| D. | 取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L |
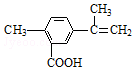
| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
| A. | 电池工作时,溶液中的铝离子向正极移动 | |
| B. | 该电池可能是一种可充电的二次电池 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 该电池负极的电极反应为:Al-3e-═Al3+ |