题目内容
14.已知下列两个热化学方程式;2H2(g)+O2(g)═2H2O(1);△H=-570.kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共1mol,完全燃烧生成液态水时放热1252.5kJ,则混合气体中H2和C3H8的体积比是1:1.
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式.C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044KJ/mol.
分析 (1)设氢气为xmol,则丙烷为(1-x)mol,热化学方程式中物质的量与热量成正比,结合混合气体1mol完全燃烧生成液态水时放热1252.5kJ计算;
(2)由①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ/mol
②H2O(1)=H2O(g)△H=+44.0kJ/mol,
结合盖斯定律可知,①+②×4得到C3H8(g)+5O2(g)=3CO2(g)+4H2O(g),以此来解答.
解答 解:(1)设氢气为xmol,则丙烷为(1-x)mol,
H2和C3H8的混合气体共1mol,完全燃烧生成液态水时放热1252.5kJ,则
570x+(1-x)×2220=1252.5,
解得x=0.5mol,
则混合气体中H2和C3H8的体积比是0.5mol×Vm:(1mol-0.5mol)×Vm=1:1,
故答案为:1:1;
(2)由①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ/mol
②H2O(1)=H2O(g)△H=+44.0kJ/mol,
结合盖斯定律可知,①+②×4得到C3H8(g)+5O2(g)=3CO2(g)+4H2O(g),△H=(-2220.0kJ/mol)+(+44.0kJ/mol)×4=-2044KJ/mol,
即丙烷燃烧生成CO2和气态水的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044KJ/mol,
故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2044KJ/mol.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变及热量的计算等为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.
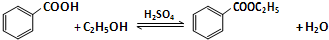
已知:
| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:
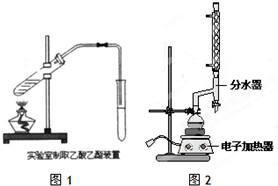
①乙醇、乙酸和浓硫酸混合的先后顺序先加乙醇,再加浓硫酸,等冷却再加乙酸;
②浓硫酸的作用是催化剂和吸水剂;
③实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,请写出发生该变化的离子反应方程式CH3COOH+CO32-=CH3COO-+HCO3-;
(2)按照图2所示装置制备苯甲酸乙酯.
①制备:在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,其中分水器的作用是分离出反应生成的水,控制温度加热回流2h.
a.实验中使用分水器不断分离除去水的目的是分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.从提供的分析实验室制取苯甲酸乙酯为什么不使用制取乙酸乙酯一样的装置?如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低;
②产品的提纯
将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入Na2CO3溶液呈中性;用分液漏斗分出有机层得粗产品.水层用25mL乙醚萃取分液,醚层与粗产品合并;在粗产品加入无水氯化钙后,静置、过滤,过滤液进行蒸馏,蒸出乙醚后,继续升温,接收210~213℃的馏分;产品经检验合格,测得产品体积为6mL.
c.在该实验分液过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”可“下口倒出”);
d.该实验中苯甲酸乙酯的产率为42%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现白烟生成,产生该现象的原因在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
| A. | 0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L | |
| B. | 1 L该溶液中含有Na2CO3的质量为10.6 g | |
| C. | 从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L | |
| D. | 取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L |
| A. | 标准状况下,将22.4 L HC1溶于1L水,可配成1 mol•L-l的稀盐酸 | |
| B. | 将100 mL 18 mol•L-1的浓H2SO4和100 mL水混合,可配成9 moI•L-l的H2SO4溶液 | |
| C. | 将4.0 g NaOH溶于100 mL容量瓶中,加水至刻度线,配成1 mol•L-1的NaOH溶液 | |
| D. | 将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol•L-l |