题目内容
17.(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、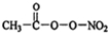 (PAN)等二次污染物.
(PAN)等二次污染物.①1mol PAN中含有的σ键数目为10NA,PAN中四种元素的第一电离能由大到小的顺序为N>O>C>H.(用元素符号表示)
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为6,中心离子的核外电子排布式为1s22s22p63s23p63d6(或[Ar]3d6).
③相同压强下,HCOOH的沸点比CH3OCH3高(填“高”或“低”),其原因是HCOOH分子间能形成氢键.
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等.
①(NH4)2SO4晶体中各种微粒间的作用力不涉及DE(填序号).
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
②NH4NO3中阳离子的空间构型为正四面体形,阴离子的中心原子轨道采用sp2杂化.
(3)检验Fe2+的方法之一是将一种配合物(填名称)铁氰化钾滴入待测溶液中,现象是产生蓝色沉淀,其离子方程式为3Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
分析 (1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,据此答题;
②配位体位于方括号中,由1个NO和5个H20分子构成;中心离子为Fe2+,铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6,据此解答;
③HCOOH分子间能形成氢键,CH30CH3不能形成分子间氢键;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键;
②铵根离子中氮原子价层电子对个数是4且不含孤电子对,硝酸根离子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论确定离子空间构型及原子杂化方式;
(3)检验Fe2+的方法,用二价铁与+3价铁元素的配合物溶液反应生成蓝色沉淀.
解答 解:(1)①一个单键就是 一个σ键,一个双键中含有一个σ键和一个π键,根据分子的结构简式可知,一个PAN中共有11个共价键,所以1mol PAN中含有的σ键数目为10NA;
同周期元素,从左到右,元素的第一电离能逐渐增大,第ⅤA族的P轨道处于半充满状态,比同周期的相邻元素第一电离能高,所以第一电离能由大到小的顺序为:NN>O>C>H,
故答案为:10NA (或6.02×1024);N>O>C>H;
②配位体位于方括号中,由1个NO和5个H2O分子构成,所以该配合物中中心离子的配位数为6;中心离子为Fe2+,铁是26号元素,则Fe2+的电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,
故答案为:6;1s22s22p63s23p63d6 (或[Ar]3d6);
③HCOOH分子间能形成氢键,CH30CH3不能形成分子间氢键,所以相同压强下,HCOOH的沸点比CH3OCH3高,
故答案为:高;HCOOH分子间能形成氢键;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键,
故答案为:DE;
②NH4+ 的中心原子氮原子价层电子对数=$\frac{5+4-1}{2}$=4,孤电子对=$\frac{5-1×4-1}{2}$=0,所以NH4+ 的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=$\frac{5+1}{2}$=3,所以氮原子按sp2方式杂化,
故答案为:正四面体;sp2;
(3)检验Fe2+的方法,用二价铁与+3价铁元素的配合物溶液反应生成蓝色沉淀的离子方程式为:3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓,
故答案为:铁氰化钾;3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓.
点评 本题考查化学键判断、微粒空间构型判断、原子杂化方式、离子方程式的书写等判断等知识点,侧重考查基本概念及知识运用能力,难点是孤电子对的计算方法,题目难度中等.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | 16g由O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA | |
| C. | 100mL 12mol/L浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA | |
| D. | 0.3molAgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ ),用排水收集到气体的分子数为0.25NA |
| A. | H3PO2溶于水的电离方程式为:H3PO2?H++H2PO2- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-═O2↑+4H+ |
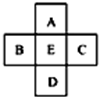
| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
(1)A组属于原子晶体,其熔化时克服的微粒间的作用力是共价键.
(2)C组中HF熔点反常是由于HF分子间能形成氢键,其熔化时需要消耗的能量更多.
(3)D组晶体可能具有的性质是②④(填序号).
①硬度非常高 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
 合理选择饮食,有益身体健康.小明家某次晚餐菜谱如图所示.
合理选择饮食,有益身体健康.小明家某次晚餐菜谱如图所示.
 短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).
短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).