题目内容
9. 短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).
短周期元素A、B、C的位置如图所示:已知B、C两元素的原子序数之和是A元素的4倍,则C为氯(填元素名称).
分析 由短周期元素A、B、C在周期表中的位置,可知A处于第二周期,B、C处于第三周期,令A的原子序数为x,用x表示出B、C的原子序数,根据B、C元素的原子序数之和是A元素原子序数的4倍列方程求x,判断A、B、C元素.
解答 解:令A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+1,则:(x+8-1)+(x+8+1)=4x,解得x=8,所以A为O元素,B为P元素,C为Cl元素,
故答案为:氯.
点评 本题考查元素周期表的结构,难度不大,根据短周期特点确定元素所在周期,注意掌握同主族元素原子序数关系,利用最外层电子数确定更简单.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
19.氮化硅是新型无机非金属材料,其中Si与N原子最外层均达到8电子结构.下列关于它的说法不正确的是( )
| A. | 硅与氮的原子数之比为4:3 | |
| B. | 氮原子与硅原子间以共价键相结合 | |
| C. | 熔点高,硬度大,可用于制造柴油机 | |
| D. | amol氮化硅含有质子数的物质的量为70amol |
20.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 22.4L乙烷中含有的共价键数为7NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA |
14.下列说法不正确的是( )
| A. | 化学反应中一定有化学键断裂,同时也有化学键形成 | |
| B. | 只有共价键的物质一定是共价化合物 | |
| C. | 含有阴离子的化合物一定含有阳离子 | |
| D. | 非金属元素和非金属元素形成的化合物不一定是离子化合物 |
1.在氧气中充分灼烧1.20g S和Fe组成的化合物,使其中的S全部转化为SO2,将这些SO2与Cl2反应全部转化为H2SO4,共消耗标况下氯气0.44L,则原化合物中S的质量分数为( )
| A. | 53% | B. | 46% | C. | 18% | D. | 36% |
18.有机物分子中原子间或原子与原子团间的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
19.下列说法正确的是( )
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
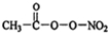 (PAN)等二次污染物.
(PAN)等二次污染物.