题目内容
7.现有几组物质的熔点(℃)数据:| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
(1)A组属于原子晶体,其熔化时克服的微粒间的作用力是共价键.
(2)C组中HF熔点反常是由于HF分子间能形成氢键,其熔化时需要消耗的能量更多.
(3)D组晶体可能具有的性质是②④(填序号).
①硬度非常高 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
分析 (1)根据物质的组成和熔点可知A组属于原子晶体,B组属于金属晶体,C组形成分子晶体,D组是离子晶体;
(2)由于HF中存在氢键,导致HF的沸点比其它氢化物的沸点高;
(3)D组物质为离子晶体,根据离子晶体的性质判断.
解答 解:(1)A组熔点最高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键;
故答案为:原子;共价键;
(2)N、O、F元素的电负性较强,对应的氢化物或含氢化合物可形成氢键,由于HF中存在氢键,导致HF的沸点比其它氢化物的沸点高,
故答案为:HF分子间能形成氢键,其熔化时需要消耗的能量更多;
(3)D组物质为离子晶体,有硬度大,但不是非常高,水溶液能导电、固体不能导电而熔融状态能导电的性质,
故答案为:②④.
点评 本题考查晶体的性质,通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常,题目难度不大.

练习册系列答案
相关题目
18.有机物分子中原子间或原子与原子团间的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
15.下列各组物质中,用溴水或高锰酸钾酸性溶液均能鉴别的是( )
| A. | 1-己烯、苯 | B. | 乙烯、乙炔 | C. | 甲苯、苯 | D. | 己烷、戊烷 |
2.已知R2+离子核外有a个电子,b个中子.表示R原子组成正确的是( )
| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
12.下列叙述中能肯定A金属比B金属活泼性强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 1mol A从酸中置换 H+生成的H2比 1mol B从酸中置换H+生成的H2多 | |
| D. | A金属可以把B金属从其盐溶液中置换出来 |
19.下列说法正确的是( )
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
17.在1.01×105Pa、150℃条件下,某烃完全燃烧反应前后压强不发生变化,该有机物可能是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
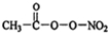 (PAN)等二次污染物.
(PAN)等二次污染物.