题目内容
9.设NA代表阿伏加德罗常数,下列说法不正确的是( )| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积是11.2 L |
分析 A.依据反应方程式结合电子转移计算;
B.依据n=$\frac{N}{N{\;}_{A}}$和m=n•M计算;
C.氮气为双原子分子,依据质量求出物质的量和原子数;
D.依据n=$\frac{N}{N{\;}_{A}}$和V=n•Vm计算.
解答 解:A.在3NO2+H2O═2HNO3+NO的反应中,反应物NO2中N元素的化合价由+4价分别升高为+5价和降低到+2价,所以NO23mol转移电子数为2mol;则1.5molNO2与足量的H2O反应,转移的电子数为NA;故A正确;
B.0.5NA个CO2分子的物质的量为n=$\frac{N}{N{\;}_{A}}$=0.5mol,则其质量为m=n•M=0.5mol×44g/mol=22g,故B正确;
C.氮气为双原子分子,28克氮气的物质的量为n=$\frac{m}{M}$=$\frac{28g}{28g/mol}$1mol,则氮原子为2mol,所以所含的原子数目为2NA,故C错误;
D.在标准状况下,0.5NA个氯气的物质的量为n=$\frac{N}{N{\;}_{A}}$=0.5mol,则V=n•Vm=0.5mol×22.4L/mol=11.2L,故D正确;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要微粒数与物质的量的换算,气体摩尔体积的应用,氧化还原反应的电子转移计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 若有1 mol NO3-发生氧化反应,则转移8 mol e- | |
| D. | Fe3+的氧化性比HNO3弱 |
11.常温下将pH=3的盐酸与pH=11的氨水等体积混合后,离子浓度大小关系正确的是( )
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(NH4+)+c(H+)>c(Cl-)+c(OH-) |


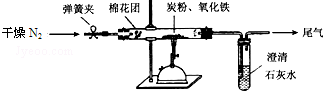
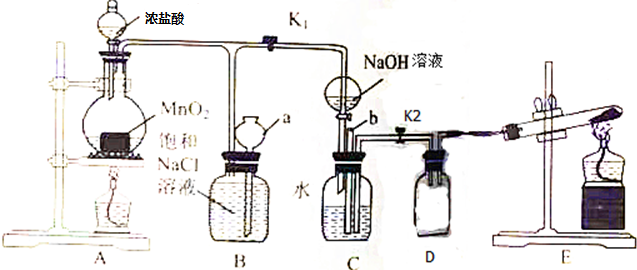
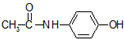 )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
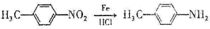 .
. ;
; ;
; ;
; .
.