题目内容
10.对乙酰氨基苯酚M(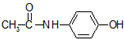 )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等.M的一种合成路线如下:
已知:①X、Y、T分子的核碰共振氢谱只显示1组峰,且X能使溴水褪色;
②
 .
.(1)X、Y的结构简式为CH2=CH2、
 ;
;(2)Ⅲ的反应类型为取代反应,Ⅵ的反应方程式为
 ;
;(3)M与足量氢氧化钠溶液反应的化学方程式为
 ;
;(4)M有多种同分异构体,其中一类与J互为同系物且氮原子与苯环直接相连,此类同分异构体共有9种;
另一类同分异构体同时满足下列条件①属于对位二取代苯且苯环上连有-NH2;②能发生水解反应;③核碰共振氢谱有4组峰.写出其中一种同分异构体的结构简式
 .
.
分析 根据流程图知,X中含有两个C原子,X发生氧化反应生成Y,X、Y、T分子的核碰共振氢谱只显示1组峰,且X能使溴水褪色,则X为CH2=CH2,X被催化氧化得到Y,根据Y分子式及核磁共振氢谱知,Y结构简式为 ;Y发生反应生成Z,根据Z分子式、W结构简式知,反应I为加成反应,Z结构简式为CH3COOH,反应II为取代反应,W结构简式为CH3COOOCCH3;
;Y发生反应生成Z,根据Z分子式、W结构简式知,反应I为加成反应,Z结构简式为CH3COOH,反应II为取代反应,W结构简式为CH3COOOCCH3;
T分子的核碰共振氢谱只显示1组峰,根据J结构简式知,T发生取代反应生成J,则T结构简式为 ,结合各物质结构简式知,IV为取代反应,W和L发生取代反应生成M,据此分析解答.
,结合各物质结构简式知,IV为取代反应,W和L发生取代反应生成M,据此分析解答.
解答 解:根据流程图知,X中含有两个C原子,X发生氧化反应生成Y,X、Y、T分子的核碰共振氢谱只显示1组峰,且X能使溴水褪色,则X为CH2=CH2,X被催化氧化得到Y,根据Y分子式及核磁共振氢谱知,Y结构简式为 ;Y发生反应生成Z,根据Z分子式、W结构简式知,反应I为加成反应,Z结构简式为CH3COOH,反应II为取代反应,W结构简式为CH3COOOCCH3;
;Y发生反应生成Z,根据Z分子式、W结构简式知,反应I为加成反应,Z结构简式为CH3COOH,反应II为取代反应,W结构简式为CH3COOOCCH3;
T分子的核碰共振氢谱只显示1组峰,根据J结构简式知,T发生取代反应生成J,则T结构简式为 ,结合各物质结构简式知,IV为取代反应,W和L发生取代反应生成M,
,结合各物质结构简式知,IV为取代反应,W和L发生取代反应生成M,
(1)通过以上分析知,X、Y结构简式分别为CH2=CH2、 ,故答案为:CH2=CH2;
,故答案为:CH2=CH2; ;
;
(2)通过以上分析知,III为取代反应,VI的方程式为 ,故答案为:取代反应;
,故答案为:取代反应; ;
;
(3)M中肽键水解生成的羧基及M中酚羟基都能与NaOH反应,反应方程式为 ,故答案为:
,故答案为: ;
;
(4)M为 ,M有多种同分异构体,其中一类与J互为同系物,说明含有苯环和硝基,且氮原子与苯环直接相连,如果存在-CH2COOH基团,有邻间对三种结构;如果存在HCOOCH2-基团,有邻间对三种结构,如果存在CH3CONH-、-OH基团,有邻间对三种结构,所以符合条件的有9种;
,M有多种同分异构体,其中一类与J互为同系物,说明含有苯环和硝基,且氮原子与苯环直接相连,如果存在-CH2COOH基团,有邻间对三种结构;如果存在HCOOCH2-基团,有邻间对三种结构,如果存在CH3CONH-、-OH基团,有邻间对三种结构,所以符合条件的有9种;
另一类同分异构体同时满足下列条件①属于对位二取代苯且苯环上连有-NH2;②能发生水解反应说明含有酯基;③核碰共振氢谱有4组峰,说明含有4种氢原子,符合条件的结构简式为 ,故答案为:9种
,故答案为:9种  ;
;
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及获取信息利用信息解答问题能力,根据反应条件、反应前后分子式或结构简式差异性进行推断,Y结构简式判断易出错,难点是(4)题同分异构体种类判断,要考虑官能团异构、位置异构,题目难度中等.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案| A. | 氢氧化钠 | B. | 醋酸 | C. | 氨水 | D. | 酒精溶液 |
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积是11.2 L |
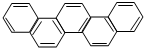 2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )
2015年,北京正在申办冬奥会.有一种有机物因其酷似奥林克五环旗,科学家称其为奥林匹克烃,下列有关奥匹克烃的说中正确的是( )| A. | 该物质属于苯的同系物 | |
| B. | 该物质的一氯代物有一种 | |
| C. | 该物质完全燃烧生成水的物质的量小于二氧化碳的物质的量 | |
| D. | 该物质的分子中只含有非极性键 |
I.(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝.写出该反应的离子反应方程式:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3).现取适量这种钴的氧化物,可与480mL 5mol•L-1盐酸恰好完全反应,得到CoCl2溶液和6.72L黄绿色气体(标准状况).则该反应的化学反应方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O.
II.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3..
| A. | S2- | B. | S | C. | SO32- | D. | SO42- |
 ,E的最高价含氧酸的化学式HClO4.
,E的最高价含氧酸的化学式HClO4. .
. ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)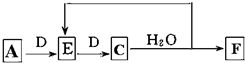
 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.