题目内容
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)⑦元素最高价氧化物晶体类型是 .
(2)⑨所在族的各元素的氢化物中沸点最低的是 (写分子式)
(3)不同元素的原子在分子内吸引电子的能力大小可用电负性x来表示,若x越大说明该元素非金属性越强,比较x(⑧) x(⑨)(填>,<或=),写出一个支持这一比较的事实(用化学方程式表示) .
(4)①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式 , .
(5)元素③的氢化物与元素⑨的氢化物反应的化学方程式为 .已知第二周期ⅡA族元素性质与⑥相似,写出该元素最高价氧化物与NaOH溶液反应的离子方程式 .
(6)已知A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,则B的原子序数b与a所有可能的关系是
A、b=a+1 B、b=a+9 C、b=a+11 D、b=a+15
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(已知Z为白色沉淀)

X溶液与Y溶液反应的离子方程式 ,M中阳离子的检验方法 .
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)⑨所在族的各元素的氢化物中沸点最低的是
(3)不同元素的原子在分子内吸引电子的能力大小可用电负性x来表示,若x越大说明该元素非金属性越强,比较x(⑧)
(4)①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式
(5)元素③的氢化物与元素⑨的氢化物反应的化学方程式为
(6)已知A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,则B的原子序数b与a所有可能的关系是
A、b=a+1 B、b=a+9 C、b=a+11 D、b=a+15
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(已知Z为白色沉淀)

X溶液与Y溶液反应的离子方程式
考点:无机物的推断,元素周期律和元素周期表的综合应用
专题:推断题,元素周期律与元素周期表专题
分析:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为S元素,⑨为Cl元素,
(1)⑦为Si,对应的氧化物为二氧化硅;
(2)HF含有氢键,沸点最高,HCl、HBr、HI中,相对分子质量越大,沸点越高;
(3)同周期元素从左到右,元素的电负性逐渐增强,可根据单质之间的置换反应证明;
(4)①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,可分别为Na2O2、NaOH等;
(5)元素③的氢化物与元素⑨的氢化物的反应为氨气和氯化氢的反应,根据氧化铝和氢氧化钠反应的离子方程式判断;
(6)考虑过渡金属的种类进行判断;
(7)由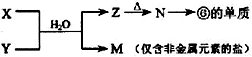 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应.
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应.
(1)⑦为Si,对应的氧化物为二氧化硅;
(2)HF含有氢键,沸点最高,HCl、HBr、HI中,相对分子质量越大,沸点越高;
(3)同周期元素从左到右,元素的电负性逐渐增强,可根据单质之间的置换反应证明;
(4)①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,可分别为Na2O2、NaOH等;
(5)元素③的氢化物与元素⑨的氢化物的反应为氨气和氯化氢的反应,根据氧化铝和氢氧化钠反应的离子方程式判断;
(6)考虑过渡金属的种类进行判断;
(7)由
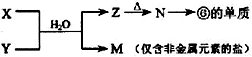 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应.
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应.解答:
解:(1)⑦为Si,对应的氧化物为二氧化硅,为原子晶体,故答案为:原子晶体;
(2)HF含有氢键,沸点最高,HCl、HBr、HI中,相对分子质量越大,沸点越高,则沸点最低的为HCl,故答案为:HCl;
(3)同周期元素从左到右,元素的电负性逐渐增强,电负性越强,对应的单质的氧化性越强,可根据单质之间的置换反应证明,如Cl2+H2S═S+2HCl,
故答案为:<;Cl2+H2S═S+2HCl;
(4)①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,可分别为Na2O2、NaOH,电子式分别为 、
、 ,故答案为:
,故答案为: ;
; ;
;
(5)元素③的氢化物与元素⑨的氢化物的反应为氨气和氯化氢的反应,方程式为NH3+HCl═NH4Cl,BeO为两性氧化物,可与氢氧化钠反应,反应的离子发生为BeO+2OH-═BeO22-+H2O,
故答案为:NH3+HCl═NH4Cl;BeO+2OH-═BeO22-+H2O;
(6)A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,如为短周期,原子序数相差1.如为4、5周期,原子序数相差11,如为第6周期,原子序数相差25,
故答案为:AC;
(7)由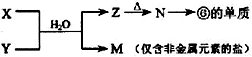 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,反应的离子方程式为Al3++3NH3.H2O═3NH4++Al(OH)3,检验铵根离子,可取少量溶液加入试管中,加入足量的浓氢氧化钠加热,将湿润的红色石蕊试纸放在管口,若试纸变成蓝色则有铵根离子,
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,反应的离子方程式为Al3++3NH3.H2O═3NH4++Al(OH)3,检验铵根离子,可取少量溶液加入试管中,加入足量的浓氢氧化钠加热,将湿润的红色石蕊试纸放在管口,若试纸变成蓝色则有铵根离子,
故答案为:Al3++3NH3.H2O═3NH4++Al(OH)3;取少量溶液加入试管中,加入足量的浓氢氧化钠加热,将湿润的红色石蕊试纸放在管口,若试纸变成蓝色则有铵根离子.
(2)HF含有氢键,沸点最高,HCl、HBr、HI中,相对分子质量越大,沸点越高,则沸点最低的为HCl,故答案为:HCl;
(3)同周期元素从左到右,元素的电负性逐渐增强,电负性越强,对应的单质的氧化性越强,可根据单质之间的置换反应证明,如Cl2+H2S═S+2HCl,
故答案为:<;Cl2+H2S═S+2HCl;
(4)①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,可分别为Na2O2、NaOH,电子式分别为
 、
、 ,故答案为:
,故答案为: ;
; ;
;(5)元素③的氢化物与元素⑨的氢化物的反应为氨气和氯化氢的反应,方程式为NH3+HCl═NH4Cl,BeO为两性氧化物,可与氢氧化钠反应,反应的离子发生为BeO+2OH-═BeO22-+H2O,
故答案为:NH3+HCl═NH4Cl;BeO+2OH-═BeO22-+H2O;
(6)A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,如为短周期,原子序数相差1.如为4、5周期,原子序数相差11,如为第6周期,原子序数相差25,
故答案为:AC;
(7)由
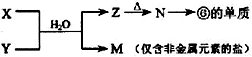 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,反应的离子方程式为Al3++3NH3.H2O═3NH4++Al(OH)3,检验铵根离子,可取少量溶液加入试管中,加入足量的浓氢氧化钠加热,将湿润的红色石蕊试纸放在管口,若试纸变成蓝色则有铵根离子,
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,反应的离子方程式为Al3++3NH3.H2O═3NH4++Al(OH)3,检验铵根离子,可取少量溶液加入试管中,加入足量的浓氢氧化钠加热,将湿润的红色石蕊试纸放在管口,若试纸变成蓝色则有铵根离子,故答案为:Al3++3NH3.H2O═3NH4++Al(OH)3;取少量溶液加入试管中,加入足量的浓氢氧化钠加热,将湿润的红色石蕊试纸放在管口,若试纸变成蓝色则有铵根离子.
点评:本题考查元素的推断,题目难度不大,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握电子式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
药物是人们生活的必备品之一,现给出四种药物的主要成分,四种反应均能发生的药物是( )
①酯化反应 ②加成反应 ③水解反应 ④中和反应

①酯化反应 ②加成反应 ③水解反应 ④中和反应

| A、维生素B3 |
| B、阿司匹林 |
| C、芬必得 |
| D、扑热息痛 |
能源是现代物质文明的原动力,与我们每个人息息相关.下列有关能量的理解正确的是( )
| A、利用盐酸与苛性钠的反应,可以制成原电池,将化学能转化为电能 |
| B、化学反应中的能量变化的大小与反应物的质量多少无关 |
| C、化学变化中的能量变化主要是由化学键变化引起的 |
| D、燃料电池的能量转化率可达100% |
 的系统命名是:
的系统命名是:
