题目内容
4.写出下列反应的化学反应方程式并且配平.(1)强碱氢氧化钠滴定强酸盐酸;
(2)氯化氢气体和氨气接触立即生成白烟;
(3)醋酸和碳酸钙反应放出气体;
(4)往硝酸银溶液中滴加氯化钠生成白色沉淀.
分析 根据反应原理确定反应物和生成物,确定反应条件,用原子守恒方法配平方程式,书写时要注意:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.
解答 解:(1)强碱氢氧化钠滴定强酸盐酸:HCl+NaOH=NaCl+H2O,故答案为:HCl+NaOH=NaCl+H2O;
(2)氯化氢气体和氨气接触立即生成白烟:NH3+HCl=NH4Cl,故答案为:NH3+HCl=NH4Cl;
(3)醋酸和碳酸钙反应放出气体:CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O,故答案为:CaCO3+2CH3COOH=(CH3COO)2Ca+CO2↑+H2O;
(4)往硝酸银溶液中滴加氯化钠生成白色沉淀:AgNO3+NaCl=AgCl↓+NaNO3,故答案为:AgNO3+NaCl=AgCl↓+NaNO3.
点评 本题考查化学反应方程式的书写,书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”,题目难度不大.

练习册系列答案
相关题目
14.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 分子式为C13H18Cl | |
| B. | 能使酸性KMnO4溶液褪色,但不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 含有两种官能团 |
15.以下说法正确的是( )
| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
12.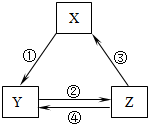 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 | ③加入盐酸 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
19.下列叙述中正确的是( )
| A. | 只有非金属原子间才能形成共价键 | |
| B. | 有化学键断裂的变化属于化学变化 | |
| C. | 由共价键形成的物质-定是共价化合物分子 | |
| D. | 离子化合物中可能含有共价键,而共价化合物中一定不含离子键 |
12.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )


| A. | 用图a所示装置干燥NH3气体 | |
| B. | 用图b所示装置蒸发NaCl溶液得NaCl晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氯气的体积 |
9.室温下,将下列气体通入到相应0.10 mol•L-1的溶液至pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系不正确的是( )
| A. | HCl→CH3COONa溶液:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | CO2→NH4HCO3溶液:c(NH4+)═c(HCO3-)+2c(CO32-) | |
| C. | SO2→NaOH溶液:c(Na+)═c(SO32-)+c(HSO3-)+c(H2SO3) | |
| D. | Cl2→NaOH溶液:2c(Cl-)═c(Na+)+c(HClO) |
10.下列说法正确的是( )
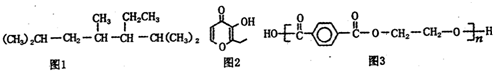

| A. | 按系统命名法命名,图1化合物的名称是2,4,6一三甲基-5-乙基庚烷 | |
| B. | 图2有机物的一种芳香族同分异构体能发生银镜反应 | |
| C. | 图2有机物能使酸性高锰酸钾溶液褪色 | |
| D. | 图3为髙分子化合物,其单体为对苯二甲酸和乙醇 |
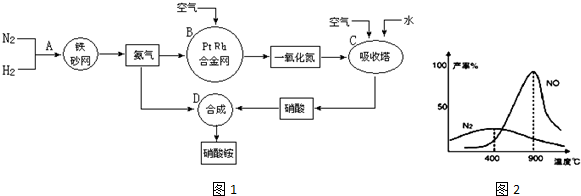
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.