题目内容
6.下列说法正确的是( )| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫牺牲阳极的阴极保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
分析 A.利用电解熔融的氯化镁来冶炼金属Mg;
B.根据在原电池中,负极金属的腐蚀速率远大于正极金属的腐蚀速率;
C.为防止金属被腐蚀,如果利用牺牲阳极的阴极保护法保护金属,则被保护的金属作原电池正极;
D.不锈钢有较强的抗腐蚀能力不锈钢有较强的抗腐蚀能力是铁与以铬为主,再添加如镍、锰、钼等元素冶炼而成的合金.
解答 解:A.利用电解熔融的氯化镁来冶炼金属Mg,而电解MgCl2饱和溶液生成氢氧化镁沉淀、氢气、氯气,故A错误;
B.镀层破损后,镀锡铁中,金属铁为负极,易被腐蚀,镀锌铁中,金属铁是正极,被保护,所以镀锡铁中铁的腐蚀速率更快,故B正确;
C.为防止金属被腐蚀,如果利用牺牲阳极的阴极保护法保护金属,则被保护的金属作原电池正极,应该选取比铁活泼的金属作原电池负极,一般在轮船身上装有一定数量的锌,故C错误;
D.不锈钢有较强的抗腐蚀能力不锈钢有较强的抗腐蚀能力不是因为在钢铁表面镀上了铬,而铁与以铬为主,再添加如镍、锰、钼等元素冶炼而成的合金,故D错误;
故选B.
点评 本题主要考查原电池和电解池原理的应用,难度不大,掌握原电池和电解池的原理即可完成.

练习册系列答案
相关题目
17.为了检验和除去表中的各种杂质(括号里的物质为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
①检验的试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:CH2=CH2+Br2→BrCH2CH2Br.
| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | B | d |
| 酒 精(水) | A | c |
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:CH2=CH2+Br2→BrCH2CH2Br.
14.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 分子式为C13H18Cl | |
| B. | 能使酸性KMnO4溶液褪色,但不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 含有两种官能团 |
11.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
18.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 12C和石墨互为同素异形体 | |
| C. | Cl?、S2?、Ca2+、K+半径逐渐减小 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
15.以下说法正确的是( )
| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
12.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )


| A. | 用图a所示装置干燥NH3气体 | |
| B. | 用图b所示装置蒸发NaCl溶液得NaCl晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氯气的体积 |
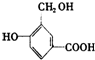 的结构回答下列问题:
的结构回答下列问题: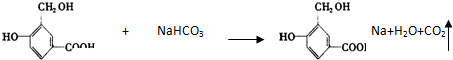
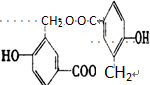 .
.