题目内容
在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.
通过测定氧气的体积随时间的变化做出了如图甲所示,
请回答下列问题:
(1)代表实验①的图示是 .
(2)对比实验③和④的目的是
(3)通过上面对比实验,所得的实验结论是:
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图乙.
(4)从开始反应到t1时刻,氨气的平均反应速率为 .
(5)在t2时刻,氢气的转化率为 .
(6)在t3时刻,对于可逆反应所达状态,下列说法正确的有 .
①体系压强不再改变; ②一个N≡N键断裂的同时,有6个N-H键断裂;
③密度不再改变; ④混合气体的平均相对分子质量不再改变;
⑤正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=0.4mol/(L?min)
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 | 40℃ |

请回答下列问题:
(1)代表实验①的图示是
(2)对比实验③和④的目的是
(3)通过上面对比实验,所得的实验结论是:
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图乙.
(4)从开始反应到t1时刻,氨气的平均反应速率为
(5)在t2时刻,氢气的转化率为
(6)在t3时刻,对于可逆反应所达状态,下列说法正确的有
①体系压强不再改变; ②一个N≡N键断裂的同时,有6个N-H键断裂;
③密度不再改变; ④混合气体的平均相对分子质量不再改变;
⑤正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=0.4mol/(L?min)
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,产物的百分含量随浓度、时间的变化曲线,探究影响化学反应速率的因素
专题:化学平衡专题,化学反应速率专题
分析:(1)根据温度、浓度、催化剂对反应速率的影响进行判断;
(2)实验③和④反应物的浓度、温度相同,不同条件为是否使用催化剂,据此判断对比实验③和④的目的;
(3)根据表中反应物浓度、反应温度、是否使用催化剂对反应速率的影响得出结论;
(4)t1时刻氮气的物质的量为0.5mol,根据反应速率的表达式及反应方程式计算出从开始反应到t1时刻,氨气的平均反应速率;
(5)根据图象判断在t2时刻氮气的物质的量,再根据反应方程式计算出消耗的氢气的物质的量,最后计算出氢气的转化率;
(6)根据图象可知,在t3时刻已经达到平衡状态,根据化学平衡状态的特征进行判断.
(2)实验③和④反应物的浓度、温度相同,不同条件为是否使用催化剂,据此判断对比实验③和④的目的;
(3)根据表中反应物浓度、反应温度、是否使用催化剂对反应速率的影响得出结论;
(4)t1时刻氮气的物质的量为0.5mol,根据反应速率的表达式及反应方程式计算出从开始反应到t1时刻,氨气的平均反应速率;
(5)根据图象判断在t2时刻氮气的物质的量,再根据反应方程式计算出消耗的氢气的物质的量,最后计算出氢气的转化率;
(6)根据图象可知,在t3时刻已经达到平衡状态,根据化学平衡状态的特征进行判断.
解答:
解:(1)温度越高,反应速率越快,使用催化剂,反应速率加快,浓度越大,反应速率越快,实验①中双氧水浓度最小,没有使用催化剂,温度为25℃,则在实验①~④中反应速率最小,甲中斜率越大,反应速率越快,则代表实验①的为Ⅳ,
故答案为:Ⅳ;
(2)根据表中数据可知,实验③④中反应物浓度、反应温度相同,而实验④使用了催化剂,所以对比实验③和④的目的是探究催化剂对反应速率的影响,
故答案为:探究催化剂对反应速率的影响;
(3)根据实验①②可知,增加反应物浓度,反应速率加快;根据实验②③可知,升高反应温度,反应速率加快;根据实验③④可知,使用催化剂,反应速率加快,
故答案为:增大反应物浓度,反应速率加快;升高温度,反应速率加快(或使用催化剂,反应速率加快);
(4)根据图象可知,t1时刻氮气的物质的量为0.5mol,氮气的浓度变化为:c(N2)=
=0.25mol/L,从开始反应到t1时刻,氮气的平均反应速率为:v(N2)=
=
mol/(L?min),根据反应N2(g)+3H2(g)?2NH3(g)可知,氨气的平均反应速率为:v(NH3)=2v(N2)=2×
mol/(L?min)=
mol/(L?min),
故答案为:
mol/(L?min);
(5)在t2时刻氮气的物质的量为0.25mol,反应消耗的氮气的物质的量为:1mol-0.25mol=0.75mol,根据反应N2(g)+3H2(g)?2NH3(g)可知,反应消耗的氢气的物质的量为:0.75mol×3=2.25mol,在t2时刻,氢气的转化率为:
×100%=75%,
故答案为:75%;
(6)在t3时刻与t2时刻时氮气的物质的量不再变化,说明该反应达到平衡状态,各组分的浓度、百分含量一定不再发生变化,
①体系压强不再改变;由于t3时刻达到平衡状态,则反应体系中各组分的浓度不再变化,混合气体的总物质的量不变,则压强不再变化,故①正确;
②一个N≡N键断裂,则反应消耗1分子氮气,由于达到平衡状态,则同时会消耗2mol氨气,即有6个N-H键断裂,故②正确;
③密度不再改变;混合气体的质量不变,容器的容积不变,则气体的密度始终不变,故③正确;
④混合气体的平均相对分子质量不再改变;达到平衡状态后,气体的总物质的量不变,而气体的质量始终不变,则气体的平均相对分子质量一定不变,故④正确;
⑤正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=
v(H2)=0.4mol/(L?min),故⑤正确;
故答案为:①②③④⑤.
故答案为:Ⅳ;
(2)根据表中数据可知,实验③④中反应物浓度、反应温度相同,而实验④使用了催化剂,所以对比实验③和④的目的是探究催化剂对反应速率的影响,
故答案为:探究催化剂对反应速率的影响;
(3)根据实验①②可知,增加反应物浓度,反应速率加快;根据实验②③可知,升高反应温度,反应速率加快;根据实验③④可知,使用催化剂,反应速率加快,
故答案为:增大反应物浓度,反应速率加快;升高温度,反应速率加快(或使用催化剂,反应速率加快);
(4)根据图象可知,t1时刻氮气的物质的量为0.5mol,氮气的浓度变化为:c(N2)=
| 1mol-0.5mol |
| 2L |
| 0.25mol/L |
| t1min |
| 1 |
| 4t1 |
| 1 |
| 4t1 |
| 1 |
| 2t1 |
故答案为:
| 1 |
| 2t1 |
(5)在t2时刻氮气的物质的量为0.25mol,反应消耗的氮气的物质的量为:1mol-0.25mol=0.75mol,根据反应N2(g)+3H2(g)?2NH3(g)可知,反应消耗的氢气的物质的量为:0.75mol×3=2.25mol,在t2时刻,氢气的转化率为:
| 2.25mol |
| 3mol |
故答案为:75%;
(6)在t3时刻与t2时刻时氮气的物质的量不再变化,说明该反应达到平衡状态,各组分的浓度、百分含量一定不再发生变化,
①体系压强不再改变;由于t3时刻达到平衡状态,则反应体系中各组分的浓度不再变化,混合气体的总物质的量不变,则压强不再变化,故①正确;
②一个N≡N键断裂,则反应消耗1分子氮气,由于达到平衡状态,则同时会消耗2mol氨气,即有6个N-H键断裂,故②正确;
③密度不再改变;混合气体的质量不变,容器的容积不变,则气体的密度始终不变,故③正确;
④混合气体的平均相对分子质量不再改变;达到平衡状态后,气体的总物质的量不变,而气体的质量始终不变,则气体的平均相对分子质量一定不变,故④正确;
⑤正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=
| 2 |
| 3 |
故答案为:①②③④⑤.
点评:本题考查了影响化学反应速率、化学平衡的因素、化学反应速率的计算等知识,题目难度中等,注意掌握化学反应速率、化学平衡的影响因素,明确化学平衡状态的特征,能够根据反应速率表达式及反应速率与化学计量数的关系正确计算出反应速率.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
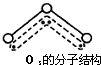 ,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答: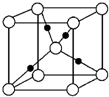 有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH
有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH 金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.