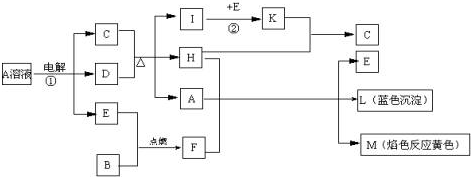
题目内容
试回答下列问题:
I.甲、乙两种元素是同一周期的相邻元素,乙元素的原子的最外层有5个电子,甲元素有多种同素异形体,其中一种能导电.若由甲、乙两元素形成的一种化合物硬度比金刚石大,则该化合物属于 晶体,其化学式为 ,若要使其熔化,需破坏的化学键为 .
II.人们一直致力于人工固氮的研究以获得廉价的氮肥.科学家先后提出并合成了固氮酶的多种模拟物.其中一类是含Mo、Fe、S原子的类立方体结构,如图所示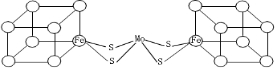 .图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.
.图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.
请在图中左边立方体的○内填写出其余3个Fe原子.
上述一个立方体中4个Fe原子所在顶点连接所构成的空间几何体为 .
I.甲、乙两种元素是同一周期的相邻元素,乙元素的原子的最外层有5个电子,甲元素有多种同素异形体,其中一种能导电.若由甲、乙两元素形成的一种化合物硬度比金刚石大,则该化合物属于
II.人们一直致力于人工固氮的研究以获得廉价的氮肥.科学家先后提出并合成了固氮酶的多种模拟物.其中一类是含Mo、Fe、S原子的类立方体结构,如图所示
 .图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.
.图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.请在图中左边立方体的○内填写出其余3个Fe原子.
上述一个立方体中4个Fe原子所在顶点连接所构成的空间几何体为
考点:晶胞的计算,原子晶体
专题:化学键与晶体结构
分析:Ⅰ甲元素有多种同素异形体,其中一种能导电,则甲为碳元素,甲、乙两种元素是同一周期的相邻元素,乙元素的原子的最外层有5个电子,所以乙为氮元素,甲、乙两元素形成的一种化合物硬度比金刚石大,则该化合物为原子晶体,根据化合价代数和为零,可知其化学式为C3N4,由于是原子晶体,里面存在共价键,所以熔化时要破坏共价键,据此答题;
Ⅱ由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,将四个顶点连接即可得到其空间构型.
Ⅱ由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,将四个顶点连接即可得到其空间构型.
解答:
Ⅰ、甲元素有多种同素异形体,其中一种能导电,则甲为碳元素,甲、乙两种元素是同一周期的相邻元素,乙元素的原子的最外层有5个电子,所以乙为氮元素,甲、乙两元素形成的一种化合物硬度比金刚石大,则该化合物为原子晶体,碳元素的非金属性小于氮元素,所以碳显正价,氮元素显负价,在该化合物中,碳元素显+4价,N元素显-3价,根据化合价代数和为零,可知其化学式为C3N4,由于是原子晶体,里面存在共价键,所以熔化时要破坏极性共价键,故答案为:原子; C3N4; 共价键或极性键;
Ⅱ、因为在图中4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键,所以在立方体中铁原子和硫原子应当交替分布,小正方体中4个铁原子应在互不相邻的顶点上,所以可画得图为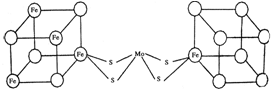 ;由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,
;由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,
故答案为: ;正四面体.
;正四面体.
Ⅱ、因为在图中4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键,所以在立方体中铁原子和硫原子应当交替分布,小正方体中4个铁原子应在互不相邻的顶点上,所以可画得图为
 ;由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,
;由信息可知,小正方体中4个铁原子应在互不相邻的顶点上,且这四个顶点连接构成正四面体,故答案为:
 ;正四面体.
;正四面体.
点评:本题考查较综合,涉及空间构型的判断、杂化方式的判断、化学式的确定、晶体结构的理解等知识点,同时考查学生空间想象能力,难度中等

练习册系列答案
相关题目
下列有关物质性质的应用正确的是( )
| A、氧化铝熔点很高,可制造用于熔融烧碱的坩埚 |
| B、炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| D、二氧化硫有漂白性,可以用于加工食品使食品增白 |
 如图为一种原电池装置图,电解质溶液为稀硫酸,回答下列问题:
如图为一种原电池装置图,电解质溶液为稀硫酸,回答下列问题: