题目内容
下列有关物质性质的应用正确的是( )
| A、氧化铝熔点很高,可制造用于熔融烧碱的坩埚 |
| B、炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C、铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| D、二氧化硫有漂白性,可以用于加工食品使食品增白 |
考点:镁、铝的重要化合物,二氧化硫的化学性质,硅和二氧化硅,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:A.氧化铝能和碱反应,故不能用于制造熔融烧碱的坩埚;
B.碳具有还原性,一定条件下能将二氧化硅还原为硅;
C.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块会加快船体的腐蚀速率;
D.二氧化硫有毒,不可以用于加工食品使食品增白.
B.碳具有还原性,一定条件下能将二氧化硅还原为硅;
C.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块会加快船体的腐蚀速率;
D.二氧化硫有毒,不可以用于加工食品使食品增白.
解答:
解:A.氧化铝熔点高,且硬度较大,可用于制造耐火砖和坩埚等,但是氧化铝能和碱反应,故不能用于制造熔融烧碱的坩埚;故A错误;
B.碳具有还原性,一定条件下能将二氧化硅还原为硅;故B正确;
C.铜、铁、海水组成原电池,铜的金属活动性比铁弱,铁做负极,被腐蚀,故在海轮外壳上装若干铜块会加快船体的腐蚀速率;故C错误;
D.二氧化硫有毒,不可以用于加工食品使食品增白;故D错误;
故选:B.
B.碳具有还原性,一定条件下能将二氧化硅还原为硅;故B正确;
C.铜、铁、海水组成原电池,铜的金属活动性比铁弱,铁做负极,被腐蚀,故在海轮外壳上装若干铜块会加快船体的腐蚀速率;故C错误;
D.二氧化硫有毒,不可以用于加工食品使食品增白;故D错误;
故选:B.
点评:题考查了常见金属、非金属及其化合物性质的分析应用,注意知识积累,题目较简单.

练习册系列答案
相关题目
下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
| A、H2S、O2、N2 |
| B、HCl、Cl2、CO2 |
| C、N2、H2、CO |
| D、SO2、Cl2、O2 |
物质的量浓度都为0.1mol?L-1的下列溶液中,pH最小的是( )
| A、NaCN |
| B、NaF |
| C、CH3COONa |
| D、NaNO2 |
下列有关化学用语表示正确的是( )
A、乙烯分子球棍模型: |
B、硫离子的结构示意图: |
C、NaCl的电子式: |
D、N2的结构式: |
向明矾[KAl(SO4)2?12H2O]溶液中加入Ba(OH)2溶液,当SO42-恰好沉淀完全时,这时铝元素的存在形式是( )
| A、Al(OH)3沉淀 |
| B、只有〔AlO2〕-离子 |
| C、Al(OH)3沉淀和Al3+ |
| D、Al(OH)3沉淀和〔AlO2〕-离子 |
化学与生活密切相关,下列说法不正确的是( )
| A、二氧化硫可用于漂白纸浆 |
| B、向燃煤中添加石灰石可减少SO2的排放 |
| C、碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 |
| D、氮是生命体内不可缺少的元素,但多数生物不能直接从空气中吸收氮气 |
下列反应中,通入的气体物质只作为氧化剂的是( )
| A、少量氯气通入氯化亚铁酸性溶液中 |
| B、氯气通入NaOH溶液中 |
| C、二氧化硫通入水中 |
| D、硫化氢通入溴水中 |
 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O,下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O,下列说法不正确的是( )| A、电源右侧为负极 |
| B、右侧发生的电极方程式:2H++2e-═H2↑ |
| C、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变通电 |
| D、电解槽内发生反应的总化学方程式KI+3H2O═KIO3+3H2↑ |
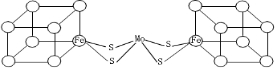 .图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.
.图中左右两边对称,各含一个近似立方体的结构.每个立方体含有4个Fe原子和4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键.