题目内容
9.在反应3Fe3O4+28HNO3═9Fe(NO3)3+NO+14H2O中,还原剂和氧化剂的物质的量之比是( )| A. | 3:28 | B. | 3:1 | C. | 9:28 | D. | 1:3 |
分析 3Fe3O4+28HNO3═9Fe(NO3)3+NO+14H2O中,Fe元素的化合价升高,N元素的化合价降低,以此来解答.
解答 解:3Fe3O4+28HNO3═9Fe(NO3)3+NO+14H2O中,Fe元素的化合价升高,N元素的化合价降低,所以四氧化三铁是还原剂,硝酸部分是氧化剂,而反应中28mol中有1mol硝酸发生还原反应,所以还原剂和氧化剂的物质的量之比是3:1,故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
19.在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是( )
| A. | NaCl | B. | H2SO4 | C. | Na2CO3 | D. | NH4Cl |
20.早在古代,我国人民就积累了不少对化学物质变化的认识.例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又成丹砂”.这句话中的丹砂指的是HgS,下列关于这句话的说法正确的是( )
| A. | 这个过程只涉及物理变化 | |
| B. | 这个过程是可逆反应 | |
| C. | 这个过程发生了复分解反应 | |
| D. | “丹砂烧之成水银”过程中还可能产生SO2 |
17.短周期元素X、Y、Z、W、Q在元素周期表中的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法不正确的是( )
| X | Y | ||||
| Z | W | Q |
| A. | Y与Z的简单离子的半径大小关系为Y2->Z2+ | |
| B. | Z单质可以在X和Y组成的化合物中燃烧 | |
| C. | W与Y组成的某种化合物是光导纤维的主要成分 | |
| D. | Q单质具有强氧化性和漂白性 |
4.下列有关实验现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?Ν2O4的△H<0 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
14.下列对有关化工生产的说法正确的是( )
| A. | 合成氨生产过程中将NH3液化分离,可以提高反应物的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室 | |
| D. | 传统硅酸盐工业中生产水泥的原料为石灰石、纯碱和石英砂 |
18.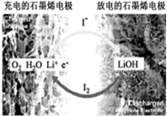 科学家开发出一种新型电池,其能量密度极高,效率达90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH,对于该电池的下列说法不正确的是( )
科学家开发出一种新型电池,其能量密度极高,效率达90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH,对于该电池的下列说法不正确的是( )
 科学家开发出一种新型电池,其能量密度极高,效率达90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH,对于该电池的下列说法不正确的是( )
科学家开发出一种新型电池,其能量密度极高,效率达90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH,对于该电池的下列说法不正确的是( )| A. | 充电时Li+从阳极区移向阴极区 | |
| B. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| C. | 放电时负极上I-被氧化 | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
19.化学与环境、生活关系密切,下列事实中不涉及化学性质的是( )
| A. | 焊锡中加铅后熔点降低 | |
| B. | 用漂白粉、臭氧等游泳池消毒 | |
| C. | 将镁块与钢铁输水管相连,防止钢铁腐蚀 | |
| D. | 往燃煤中加入石灰石,减少酸雨的产生 |
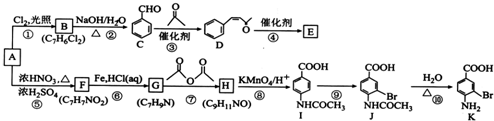
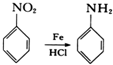
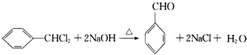 .
.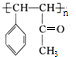 .
.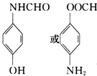 .
.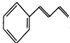 的合成路线补充完整.
的合成路线补充完整.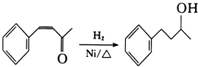 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$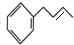 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$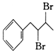 $→_{△}^{NaOH醇溶液}$
$→_{△}^{NaOH醇溶液}$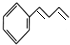 (无机试剂及溶剂任选).
(无机试剂及溶剂任选).