题目内容
18.取一定量含FeO、Fe3O4和Fe2O3的固体混合物,将其分成两等份并进行下列转化: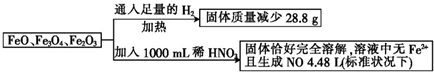
若稀HNO3恰好完全反应,则所加稀HNO3的物质的量浓度为( )
| A. | 4.0 mol•L-1 | B. | 4.4 mol•L-1 | C. | 4.8 mol•L-1 | D. | 3.6 mol•L-1 |
分析 FeO、Fe3O4 和Fe2O3的固体混合物通入足量的氢气,FeO、Fe3O4 和Fe2O3被还原成Fe单质,根据减少的质量即为氧的质量,根据几种氧化物中O为-2价,可知Fe元素所带正电荷总数,Fe元素失去一定量的电子后所带正电荷总数等于硝酸根离子所带负电荷总数,结合电子守恒分析.
解答 解:FeO、Fe3O4 和Fe2O3的固体混合物通入足量的氢气,FeO、Fe3O4 和Fe2O3被还原成Fe单质,减少的质量即为氧的质量,则n(O)=$\frac{28.8g}{16g/mol}$=1.8mol,
在这三种化合物中O元素为-2价,则O元素所带负电荷为1.8mol×2=3.6mol,由电荷守恒可知,Fe元素所带正电荷为3.6mol;
Fe元素失去一定量的电子后所带正电荷总数等于硝酸根离子所带负电荷总数,Fe元素失去的电子的物质的量等于生成NO时N元素得到的电子的物质的量,
n(电子)=$\frac{4.48L}{22.4L/mol}$×(5-2)=0.6mol,
则硝酸铁中硝酸根离子n(NO3-)=3.6mol+0.6mol=4.2mol,
反应前硝酸的物质的量=反应后硝酸铁中硝酸根离子的物质的量+NO的物质的量,
即n(HNO3)=n(NO3-)+n(NO)=4.2mol+0.2mol=4.4mol,
所以所加稀HNO3的物质的量浓度为$\frac{4.4mol}{1L}$=4.4mol•L-1,故选B.
点评 本题考查Fe及化合物的性质,侧重电子守恒和原子守恒的思想的考查,此思想是解决化学计算的简洁方法,应用比较广泛,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
15.下列指定反应的离子方程式正确的是( )
| A. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 钠和CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 用食醋溶解水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
6.已知下列两个热化学方程式:2CO(g)+O2(g)=2CO2(g)△=-586.7kJ•mol-1;2H2(g)+O2(g)=2H2O(l)△=-571.6kJ•mol-1,实验测得:CO与H2的混合气体5.8g,完全燃烧时,放出的热量为87.25kJ,则混合气体中CO和H2的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 1:3 |
13.碳纳米管是由石墨的一层网状结构卷曲成的单层或多层的管状结构,是继C60发现以后的又一种热点材料,下列叙述不正确的是( )
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |
3.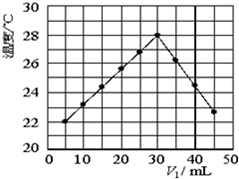 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )| A. | 做该实验时环境温度可能为20℃ | B. | 该实验表明化学能可以转化为热能 | ||
| C. | NaOH溶液的浓度约是1.5mol•L-1 | D. | 该实验表明中和反应是放热反应 |
8.下列关于氧化还原反应的说法正确的是( )
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
