题目内容
15.下列指定反应的离子方程式正确的是( )| A. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 钠和CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 用食醋溶解水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
分析 A.水解分步进行,以第一步水解为主;
B.反应生成硫酸钠、氢氧化铜和氢气;
C.醋酸在离子反应中保留化学式;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.碳酸钠的水解的离子反应为CO32-+H2O?HCO3-+OH-,故A错误;
B.钠和CuSO4溶液反应的离子反应为2Na+2H2O+Cu2+═+H2↑+Cu(OH)2↓+2Na+,故B错误;
C.用食醋溶解水垢的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑,故C错误;
D.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
3.将10g碳酸钙固体高温煅烧一段时间,冷却后投入足量的稀盐酸中完全反应.有关结论错误的是( )
| A. | 共生成0.1mol氧化钙 | |
| B. | 煅烧越充分则消耗的盐酸越少 | |
| C. | 共生成0.1mol二氧化碳 | |
| D. | 煅烧后固体中氧元素的质量分数减小 |
10.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 12g金刚石含有的共价键数为4NA | |
| B. | 1.00molNaCl中约含有6.02×1023个NaCl分子 | |
| C. | 常温下,23g NO2和N2O4的混合物含有1.5NA个原子 | |
| D. | agC2H4和C3H6的混合物所含共用电子对数目为($\frac{a}{7}$+1)NA |
20.某气体MO2在20℃、1.013x105 Pa的条件下,对氢气的相对密度是23,则M的相对原子质量是( )
| A. | 12 | B. | 14 | C. | 28 | D. | 32 |
4.下列反应的离子方程式中,正确的是( )
| A. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
18.取一定量含FeO、Fe3O4和Fe2O3的固体混合物,将其分成两等份并进行下列转化:
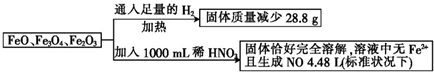
若稀HNO3恰好完全反应,则所加稀HNO3的物质的量浓度为( )

若稀HNO3恰好完全反应,则所加稀HNO3的物质的量浓度为( )
| A. | 4.0 mol•L-1 | B. | 4.4 mol•L-1 | C. | 4.8 mol•L-1 | D. | 3.6 mol•L-1 |