题目内容
现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是 .
(2)本实验应选择的指示剂是:
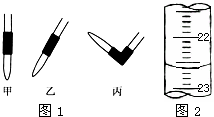
(3)如图是酸式滴定管中液面在滴定前后的读数:c (NaOH)= .

(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是
(2)本实验应选择的指示剂是:
(3)如图是酸式滴定管中液面在滴定前后的读数:c (NaOH)=

考点:中和滴定
专题:
分析:(1)滴定管使用前用蒸馏水洗净后再用所盛放的溶液润洗;
(2)强酸滴定强碱可以用酚酞或甲基橙;
(3)根据关系式c(待测)×V(待测)=c(标准)×V(标准).
(2)强酸滴定强碱可以用酚酞或甲基橙;
(3)根据关系式c(待测)×V(待测)=c(标准)×V(标准).
解答:
解:(1)滴定管使用前用蒸馏水洗净后在再所盛放的溶液润洗,
故答案为:用标准盐酸润洗2-3次;
(2)强酸滴定强碱可以用酚酞或甲基橙,故答案为:酚酞或甲基橙;
(3)中和滴定中盐酸和NaOH的物质的量相等,(V2-V1)a=c (NaOH)V,则c (NaOH)=
;
故答案为:
.
故答案为:用标准盐酸润洗2-3次;
(2)强酸滴定强碱可以用酚酞或甲基橙,故答案为:酚酞或甲基橙;
(3)中和滴定中盐酸和NaOH的物质的量相等,(V2-V1)a=c (NaOH)V,则c (NaOH)=
| a(V2-V1) |
| V |
故答案为:
| a(V2-V1) |
| V |
点评:本题主要考查了中和滴定操作及计算,题目难度不大,侧重于考查学生的实验操作能力,

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液得到9克沉淀,对样品所含杂质的正确判断是( )
| A、肯定没有KNO3 |
| B、肯定没有Ba(NO3)2和KNO3 |
| C、肯定没有Ba(NO3)2,可能有Na2CO3 |
| D、肯定没有Ba(NO3)2,可能有KNO3 |
下列各组离子,能在溶液中大量共存的是( )
| A、H+、K+、OH- |
| B、H+、Cl-、CO32- |
| C、Ba+、Na+、SO42- |
| D、Na+、Cu2+、Cl- |
锌与100mL1mol/L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠或②溴化铜或③醋酸铜(均为可溶性),并测定生成H2的速率(mL/min),预计三种方案的速率大小是( )
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
有NaCl、FeCl3、CuCl2、CaCO3,能区分他们的最简单的试剂是( )
| A、盐酸 | B、水 |
| C、氢氧化钠溶液 | D、酒精 |

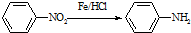 (苯胺,易被氧化)
(苯胺,易被氧化)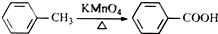
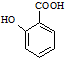 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有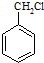 和其他无机物合成
和其他无机物合成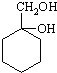 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例: