题目内容
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2~3次后,向其中注入0.10mol?L-1标准浓度的盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好由浅红色变为无色,且半分钟内颜色不再改变,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)配制标准盐酸时,除量筒外还需用下列哪些仪器? .
A.托盘天平 B.容量瓶 C.酸式滴定管 D.玻璃棒 E.烧杯 F.胶头滴管
(2)该小组在步骤①中的错误是 ,由此造成的测定结果 (偏高、偏低或无影响).
(3)排去碱式滴定管中气泡的方法应采用如图1所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
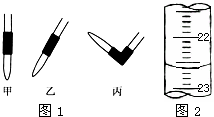
(4)如图2,是某次滴定时的滴定管中的液面,其读数为 mL.
(5)根据下列数据:
请计算待测烧碱溶液的浓度为 .
①将碱式滴定管用蒸馏水洗净,待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2~3次后,向其中注入0.10mol?L-1标准浓度的盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好由浅红色变为无色,且半分钟内颜色不再改变,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)配制标准盐酸时,除量筒外还需用下列哪些仪器?
A.托盘天平 B.容量瓶 C.酸式滴定管 D.玻璃棒 E.烧杯 F.胶头滴管
(2)该小组在步骤①中的错误是
(3)排去碱式滴定管中气泡的方法应采用如图1所示操作中的

(4)如图2,是某次滴定时的滴定管中的液面,其读数为
(5)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
考点:中和滴定
专题:实验题
分析:(1)据配制一定物质的量浓度的溶液的配制步骤选择仪器;
(2)锥形瓶用蒸馏水洗净后,直接加入待测液;用待测溶液润洗锥形瓶,待测液的物质的量偏大;
(3)根据碱式滴定管中排气泡的方法;
(4)根据滴定管的结构和精确度;
(5)先分析数据的有效性,然后求出两组平均消耗V(NaOH),最后根据HCl+NaOH=NaCl+H2O计算.
(2)锥形瓶用蒸馏水洗净后,直接加入待测液;用待测溶液润洗锥形瓶,待测液的物质的量偏大;
(3)根据碱式滴定管中排气泡的方法;
(4)根据滴定管的结构和精确度;
(5)先分析数据的有效性,然后求出两组平均消耗V(NaOH),最后根据HCl+NaOH=NaCl+H2O计算.
解答:
解:(1)配制一定物质的量浓度的盐酸时,步骤有计算、量取、稀释、转移、洗涤、定容、摇匀等,需要仪器有:量筒、胶头滴管、容量瓶、量筒、烧杯及玻璃棒,所以除量筒外还需用BDEF;
故答案为:BDEF;
(2)锥形瓶用蒸馏水洗净后,直接加入待测液,不能润洗,否则影响测定结果;用待测溶液润洗锥形瓶,待测液的物质的量偏大,造成V(标)偏大,测定结果偏高;
答案为:用待测液润洗锥形瓶;偏高;
(3)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,故选:丙;
(4)滴定时的滴定管中的液面,其读数为22.60mL;
故答案为:22.60;
(5)两次滴定消耗的体积为:24.9mL,25.10mL,均有效,则平均消耗V(NaOH)=25.00mL,
HCl+NaOH=NaCl+H2O
0.025L×0.10mol?L-1 (NaOH)×0.020L
则C(NaOH)=0.125mol?L-1
故答案为:0.125mol?L-1 .
故答案为:BDEF;
(2)锥形瓶用蒸馏水洗净后,直接加入待测液,不能润洗,否则影响测定结果;用待测溶液润洗锥形瓶,待测液的物质的量偏大,造成V(标)偏大,测定结果偏高;
答案为:用待测液润洗锥形瓶;偏高;
(3)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,故选:丙;
(4)滴定时的滴定管中的液面,其读数为22.60mL;
故答案为:22.60;
(5)两次滴定消耗的体积为:24.9mL,25.10mL,均有效,则平均消耗V(NaOH)=25.00mL,
HCl+NaOH=NaCl+H2O
0.025L×0.10mol?L-1 (NaOH)×0.020L
则C(NaOH)=0.125mol?L-1
故答案为:0.125mol?L-1 .
点评:本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列关于苯乙烯(结构简式为 -CH=CH2)的叙述错误的是( )
-CH=CH2)的叙述错误的是( )
 -CH=CH2)的叙述错误的是( )
-CH=CH2)的叙述错误的是( )| A、可以和溴水反应 |
| B、是苯的同系物 |
| C、分子中有4个碳碳双键 |
| D、1mol苯乙烯可以和4mol H2发生加成反应 |
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作导致结果偏低的是( )
| A、酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B、锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C、滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D、滴定前读数正确,达到滴定终点后,俯视读数 |
一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只减少2.9g,则此有机物不可能是( )
| A、乙烷 | B、乙烯 | C、乙醇 | D、乙二醇 |
假设SiO2晶体中Si原子被Al原子取代,不足的价数由K原子补充,当有
的Si原子被Al原子取代时可形成正长石,则正长石的化学组成为( )
| 1 |
| 4 |
| A、K2O?Al2O3?4SiO2 |
| B、K2O?Al2O3?6SiO2 |
| C、K2O?Al2O3?8SiO2 |
| D、K2O?Al2O3?2SiO2 |
 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4?xH2O)中x值.通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O